よむ、つかう、まなぶ。
参考資料1:令和5年度厚生労働科学特別研究事業(沖田班)総括研究 報告書一部抜粋 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
番
号
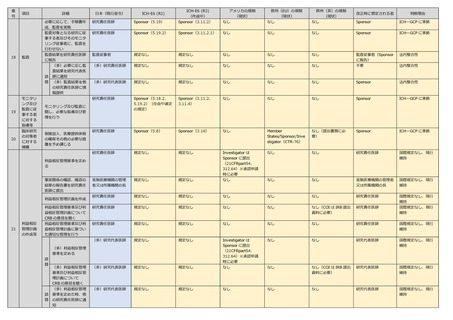
53
項目
詳細
日本(現行省令)
い旨の決定をした場合に
は、当該特定臨床研究の
対象者等に対し、遅滞な
く、その旨を通知する
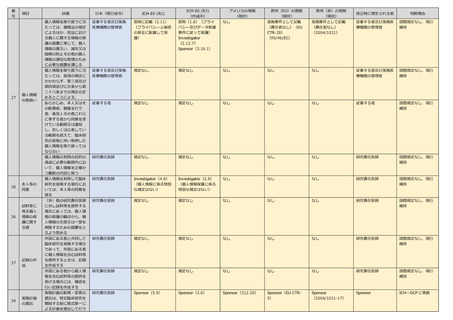
記録の保
存
55
認定臨床
研究審査
委員会へ
の疾病等
の報告
認定臨床
研究審査
委員会へ
の不具合
報告
ICH-E6 (R3)
(作成中)
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
特定臨床研究の対象者等
から求められた措置の全
部又は一部について、そ
の措置をとらない旨を通
知する場合は、当該特定
臨床研究の対象者等に対
し、その理由を説明する
よう努める
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
特定臨床研究が終了した
日から五年間、書類及び
記録とともに保存する
研究責任医師
Investigator(4.9)
Sponsor(5.5)
Investigator(2.12)
Sponsor(3.16)
Sponsor(312.57)
Sponsor/Investigator
(EU-CTR 56)
Sponsor/Investigator
(2006/3-18)
Sponsor/研究責任医
師
ICHーGCP に準拠
記録の修正を行う場合
は、修正者の氏名及び修
正を行った年月日を記録
し、修正した記録ととも
に保存する
研究責任医師
Investigator(4.9)
Sponsor(5.5)
Investigator(2.12)
Sponsor(3.16)
Sponsor(312.57)
Sponsor/Investigator
(EU-CTR 56)
なし
Sponsor/研究責任医
師
ICHーGCP に準拠
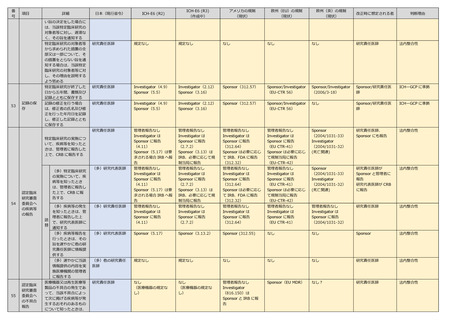
研究責任医師
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
Sponsor(5.17)は要
求される場合 IRB へ報
告
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
Sponsor(5.17)は要
求される場合 IRB へ報
告
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
Sponsor(3.13)は
IRB、必要に応じて規
制当局に報告
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
Sponsor(3.13)は
IRB、必要に応じて規
制当局に報告
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
Sponsor は必要に応じ
て IRB、FDA に報告
(312.32)
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
Sponsor は必要に応じ
て IRB、FDA に報告
(312.32)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
Sponsor は必要に応じ
て規制当局に報告
(EU-CTR-42)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
Sponsor は必要に応じ
て規制当局に報告
(EU-CTR-42)
Sponsor
(2004/1031-33)
Investigator
(2004/1031-32)
(死亡関連)
研究責任医師、
Sponsor にも報告
法内整合性
Sponsor
(2004/1031-33)
Investigator
(2004/1031-32)
(死亡関連)
研究責任医師が
Sponsor と管理者に
報告
研究代表医師が CRB
に報告
法内整合性
特定臨床研究の実施につ
いて、疾病等を知ったと
きは、管理者に報告した
上で、CRB に報告する
54
ICH-E6 (R2)
(多)特定臨床研究
の実施について、疾
病等を知ったとき
は、管理者に報告し
た上で、CRB に報
告する
読
替
(多)研究代表医師
(多)疾病等の発生
を知ったときは、管
理者に報告した上
で、研究代表医師に
通知する
(多)研究責任医師
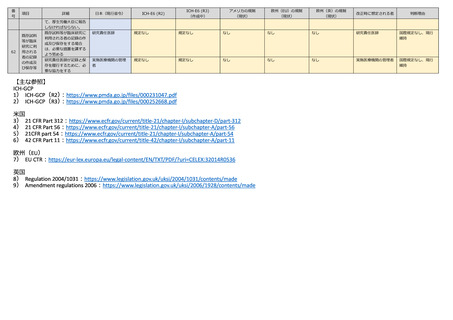
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
管理者報告なし
Investigator は
Sponsor に報告
(2004/1031-32)
研究責任医師
法内整合性
(多)疾病等報告を
行ったときは、その
旨を速やかに他の研
究責任医師に情報提
供する
(多)速やかに当該
情報提供の内容を実
施医療機関の管理者
に報告する
(多)研究代表医師
Sponsor(5.17)
Sponsor(3.13.2)
Sponsor (312.55)
なし
なし
Sponsor
法内整合性
(多)他の研究責任
医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
研究責任医師
なし
(医療機器の規定な
し)
なし
(医療機器の規定な
し)
管理者報告なし
Investigator
(816.150)は
Sponsor と IRB に報
告
Sponsor(EU MDR)
なし?
研究責任医師
法内整合性
医療機器又は再生医療等
製品の不具合の発生であ
って、当該不具合によっ
て次に掲げる疾病等が発
生するおそれのあるもの
について知ったときは、
号
53
項目
詳細
日本(現行省令)
い旨の決定をした場合に
は、当該特定臨床研究の
対象者等に対し、遅滞な
く、その旨を通知する
記録の保
存
55
認定臨床
研究審査
委員会へ
の疾病等
の報告
認定臨床
研究審査
委員会へ
の不具合
報告
ICH-E6 (R3)
(作成中)
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
特定臨床研究の対象者等
から求められた措置の全
部又は一部について、そ
の措置をとらない旨を通
知する場合は、当該特定
臨床研究の対象者等に対
し、その理由を説明する
よう努める
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
特定臨床研究が終了した
日から五年間、書類及び
記録とともに保存する
研究責任医師
Investigator(4.9)
Sponsor(5.5)
Investigator(2.12)
Sponsor(3.16)
Sponsor(312.57)
Sponsor/Investigator
(EU-CTR 56)
Sponsor/Investigator
(2006/3-18)
Sponsor/研究責任医
師
ICHーGCP に準拠
記録の修正を行う場合
は、修正者の氏名及び修
正を行った年月日を記録
し、修正した記録ととも
に保存する
研究責任医師
Investigator(4.9)
Sponsor(5.5)
Investigator(2.12)
Sponsor(3.16)
Sponsor(312.57)
Sponsor/Investigator
(EU-CTR 56)
なし
Sponsor/研究責任医
師
ICHーGCP に準拠
研究責任医師
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
Sponsor(5.17)は要
求される場合 IRB へ報
告
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
Sponsor(5.17)は要
求される場合 IRB へ報
告
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
Sponsor(3.13)は
IRB、必要に応じて規
制当局に報告
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
Sponsor(3.13)は
IRB、必要に応じて規
制当局に報告
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
Sponsor は必要に応じ
て IRB、FDA に報告
(312.32)
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
Sponsor は必要に応じ
て IRB、FDA に報告
(312.32)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
Sponsor は必要に応じ
て規制当局に報告
(EU-CTR-42)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
Sponsor は必要に応じ
て規制当局に報告
(EU-CTR-42)
Sponsor
(2004/1031-33)
Investigator
(2004/1031-32)
(死亡関連)
研究責任医師、
Sponsor にも報告
法内整合性
Sponsor
(2004/1031-33)
Investigator
(2004/1031-32)
(死亡関連)
研究責任医師が
Sponsor と管理者に
報告
研究代表医師が CRB
に報告
法内整合性
特定臨床研究の実施につ
いて、疾病等を知ったと
きは、管理者に報告した
上で、CRB に報告する
54
ICH-E6 (R2)
(多)特定臨床研究
の実施について、疾
病等を知ったとき
は、管理者に報告し
た上で、CRB に報
告する
読
替
(多)研究代表医師
(多)疾病等の発生
を知ったときは、管
理者に報告した上
で、研究代表医師に
通知する
(多)研究責任医師
管理者報告なし
Investigator は
Sponsor に報告
(4.11)
管理者報告なし
Investigator は
Sponsor に報告
(2.7.2)
管理者報告なし
Investigator は
Sponsor に報告
(312.64)
管理者報告なし
Investigator は
Sponsor に報告
(EU CTR-41)
管理者報告なし
Investigator は
Sponsor に報告
(2004/1031-32)
研究責任医師
法内整合性
(多)疾病等報告を
行ったときは、その
旨を速やかに他の研
究責任医師に情報提
供する
(多)速やかに当該
情報提供の内容を実
施医療機関の管理者
に報告する
(多)研究代表医師
Sponsor(5.17)
Sponsor(3.13.2)
Sponsor (312.55)
なし
なし
Sponsor
法内整合性
(多)他の研究責任
医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
研究責任医師
なし
(医療機器の規定な
し)
なし
(医療機器の規定な
し)
管理者報告なし
Investigator
(816.150)は
Sponsor と IRB に報
告
Sponsor(EU MDR)
なし?
研究責任医師
法内整合性
医療機器又は再生医療等
製品の不具合の発生であ
って、当該不具合によっ
て次に掲げる疾病等が発
生するおそれのあるもの
について知ったときは、