よむ、つかう、まなぶ。
資料3-4 抗がんWG (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
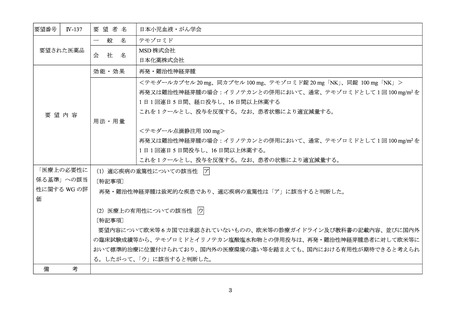
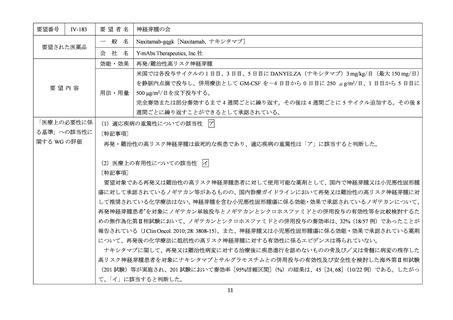
要望番号
Ⅳ-83
要望された医薬品
要望者名
日本リンパ網内系学会
一
般
名
アレムツズマブ(遺伝子組換え)
会
社
名
サノフィ株式会社
効能・効果
要望内容
用法・用量
T 細胞性前リンパ球性白血病
アレムツズマブ(遺伝子組換え)として 1 日 1 回 3 mg の連日点滴静注から開始し、1 日 1 回 10 mg を連日点滴静
注した後、1 日 1 回 30 mg を週 3 回隔日に点滴静注する。ただし、投与開始から 12 週間までの投与とする。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
T 細胞性前リンパ球性白血病は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
欧米等 6 カ国では承認されていないものの、海外診療ガイドラインにおいて T 細胞性前リンパ球性白血病に対する初回治療で
の使用が推奨されており、欧米等において標準的治療の一つに位置付けられていると考えられ、国内外の医療環境の違い等を踏
まえても国内における有用性が期待できると考えられる。したがって、「ウ」に該当すると判断した。
備
考
1
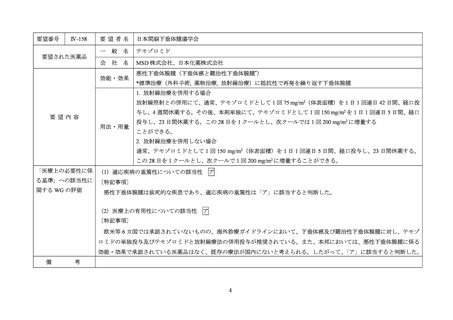
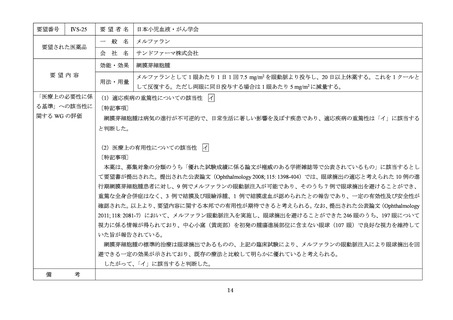
Ⅳ-83
要望された医薬品
要望者名
日本リンパ網内系学会
一
般
名
アレムツズマブ(遺伝子組換え)
会
社
名
サノフィ株式会社
効能・効果
要望内容
用法・用量
T 細胞性前リンパ球性白血病
アレムツズマブ(遺伝子組換え)として 1 日 1 回 3 mg の連日点滴静注から開始し、1 日 1 回 10 mg を連日点滴静
注した後、1 日 1 回 30 mg を週 3 回隔日に点滴静注する。ただし、投与開始から 12 週間までの投与とする。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
T 細胞性前リンパ球性白血病は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
欧米等 6 カ国では承認されていないものの、海外診療ガイドラインにおいて T 細胞性前リンパ球性白血病に対する初回治療で
の使用が推奨されており、欧米等において標準的治療の一つに位置付けられていると考えられ、国内外の医療環境の違い等を踏
まえても国内における有用性が期待できると考えられる。したがって、「ウ」に該当すると判断した。
備
考
1