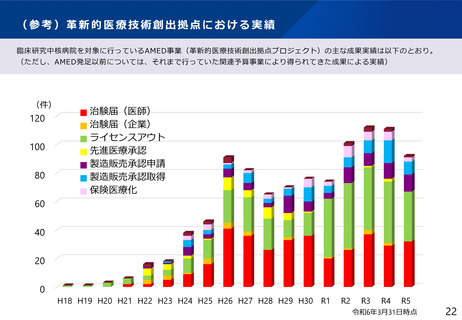
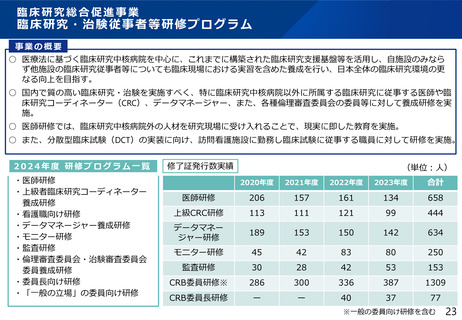
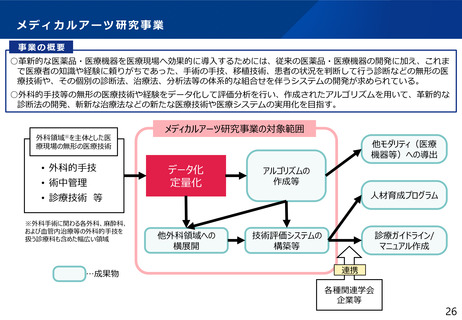
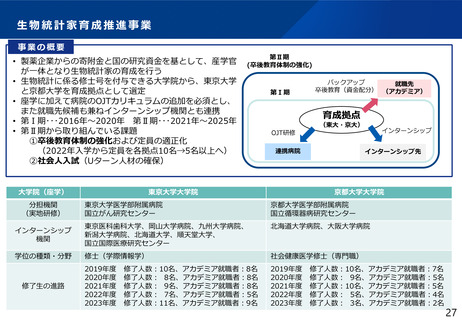
よむ、つかう、まなぶ。
参考資料1:第36回臨床研究部会資料4「臨床研究・治験推進に係る今後の方向性について」 (36 ページ)
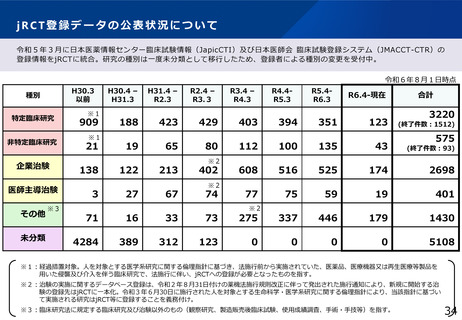
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
特定臨床研究を薬事申請に利活用する場合の留意点・考え方の例
第33回 臨床研究部会
令和5年8月23日
資料1
(抜粋)
(新たに発出した事務連絡)
● 試験計画立案の段階で、得られる結果を薬事申請に利活用することを前提とする場合は治験として行うことが原則であるものの、改めて治験を実施す
ることが困難な場合には、治験と同程度の信頼性の確保された臨床研究結果を薬事申請に利活用できる仕組みが必要。
⇒求められる信頼性の水準を満たす臨床研究については、薬事申請に利活用することができる。
● これを受け、実際に特定臨床研究で得られた試験成績を薬事申請に利用する場合の留意点・考え方について、令和4年3月にその一例を示した。
● その後、本課題にかかる令和4年度厚生労働科学特別研究事業の総括研究報告書が取りまとめられたことを受け、留意点・考え方を見直した。
信頼性の水準
「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の留意点・考え方の例示について」(令和5年3
月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡)
➢ 承認申請における当該臨床研究の位置付け等を総合的に考慮した上で求められる信頼性の水準が判断される。
➢ 研究責任医師は、根拠資料の保管を含め、当該臨床研究の適切な実施を担保するとともに、当該研究の信頼性担保の状況について説明できることが必要。
➢ 申請者は研究責任医師との間で適合性調査に関する協力体制を構築していることが望ましい。
資料作成過程の適切性
•
研究責任医師が症例報告書からデータセットの作成、集計解析及び総括報告
書の作成までの過程の適切性並びにデータの信頼性を適切に説明できる
•
また、申請者が承認申請に利用するにあたり当該手順の適切性並びにデータ
の信頼性を確認できる
医薬品の品質確保
•
•
既承認医薬品を使用している場合は、研究責任医師が適切な保管等の管理を
行い、適切な品質が保持されていることを適切に説明できる
研究責任医師が特定臨床研究に用いる医薬品の保管等の適切性を説明できる
モニタリング・監査
•
モニタリングの方法(オンサイトモニタリング、オンサイトモニタリングと中央
モニタリングの組合せ、又は中央モニタリング)は、リスク及び実施可能性に応
じて選択可能だが、その選択の妥当性を研究責任医師が適切に説明できる
•
監査の実施の必要性及び方法は、リスク及び実施可能性に応じて選択可だが、そ
の選択の妥当性を研究責任医師が適切に説明できる。
•
原資料の直接閲覧について、リスク及び実施可能性に応じて症例抽出する場合の
妥当性について研究責任医師が適切に説明できる
•
監査の実施主体が研究責任医師とは独立した第三者による実施であることを研究
責任医師が適切に説明できる
副作用情報の収集
•
(例えば、当該特定臨床研究から独立していることが確認できる臨床研究中核病院の研究支援部門が実施
等)
対象者保護の観点から副作用情報の収集状況及びその妥当性を研究責任医師
が適切に説明できる
その他
適切な患者同意
同意
•
研究責任医師が申請者による試験データの利用が可能となるような適切な患
者同意を得ていること。
利活用の可否
•
承認申請における利活用の可否は、信頼性に加え、特定臨床研究で得られた試験
成績の論文化の状況や関連ガイドラインの掲載状況等の背景情報も考慮の上、総
合的に判断される
36
第33回 臨床研究部会
令和5年8月23日
資料1
(抜粋)
(新たに発出した事務連絡)
● 試験計画立案の段階で、得られる結果を薬事申請に利活用することを前提とする場合は治験として行うことが原則であるものの、改めて治験を実施す
ることが困難な場合には、治験と同程度の信頼性の確保された臨床研究結果を薬事申請に利活用できる仕組みが必要。
⇒求められる信頼性の水準を満たす臨床研究については、薬事申請に利活用することができる。
● これを受け、実際に特定臨床研究で得られた試験成績を薬事申請に利用する場合の留意点・考え方について、令和4年3月にその一例を示した。
● その後、本課題にかかる令和4年度厚生労働科学特別研究事業の総括研究報告書が取りまとめられたことを受け、留意点・考え方を見直した。
信頼性の水準
「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の留意点・考え方の例示について」(令和5年3
月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡)
➢ 承認申請における当該臨床研究の位置付け等を総合的に考慮した上で求められる信頼性の水準が判断される。
➢ 研究責任医師は、根拠資料の保管を含め、当該臨床研究の適切な実施を担保するとともに、当該研究の信頼性担保の状況について説明できることが必要。
➢ 申請者は研究責任医師との間で適合性調査に関する協力体制を構築していることが望ましい。
資料作成過程の適切性
•
研究責任医師が症例報告書からデータセットの作成、集計解析及び総括報告
書の作成までの過程の適切性並びにデータの信頼性を適切に説明できる
•
また、申請者が承認申請に利用するにあたり当該手順の適切性並びにデータ
の信頼性を確認できる
医薬品の品質確保
•
•
既承認医薬品を使用している場合は、研究責任医師が適切な保管等の管理を
行い、適切な品質が保持されていることを適切に説明できる
研究責任医師が特定臨床研究に用いる医薬品の保管等の適切性を説明できる
モニタリング・監査
•
モニタリングの方法(オンサイトモニタリング、オンサイトモニタリングと中央
モニタリングの組合せ、又は中央モニタリング)は、リスク及び実施可能性に応
じて選択可能だが、その選択の妥当性を研究責任医師が適切に説明できる
•
監査の実施の必要性及び方法は、リスク及び実施可能性に応じて選択可だが、そ
の選択の妥当性を研究責任医師が適切に説明できる。
•
原資料の直接閲覧について、リスク及び実施可能性に応じて症例抽出する場合の
妥当性について研究責任医師が適切に説明できる
•
監査の実施主体が研究責任医師とは独立した第三者による実施であることを研究
責任医師が適切に説明できる
副作用情報の収集
•
(例えば、当該特定臨床研究から独立していることが確認できる臨床研究中核病院の研究支援部門が実施
等)
対象者保護の観点から副作用情報の収集状況及びその妥当性を研究責任医師
が適切に説明できる
その他
適切な患者同意
同意
•
研究責任医師が申請者による試験データの利用が可能となるような適切な患
者同意を得ていること。
利活用の可否
•
承認申請における利活用の可否は、信頼性に加え、特定臨床研究で得られた試験
成績の論文化の状況や関連ガイドラインの掲載状況等の背景情報も考慮の上、総
合的に判断される
36