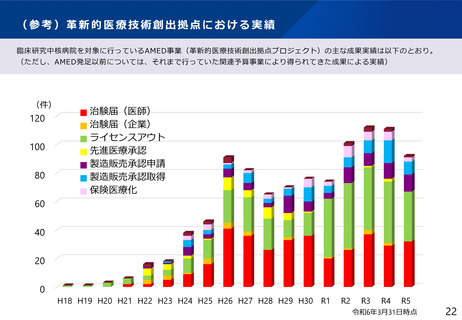
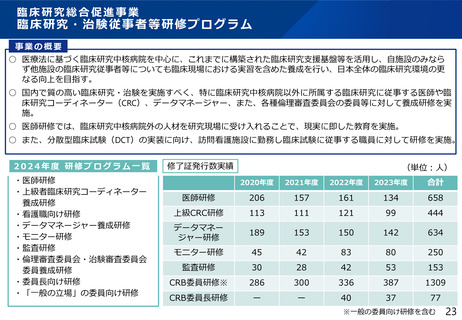
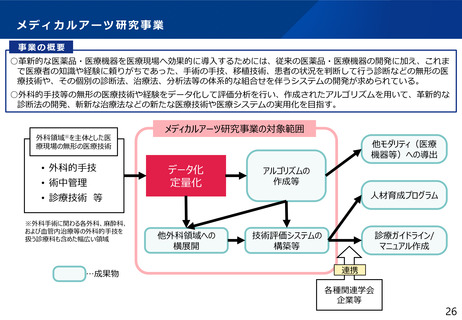
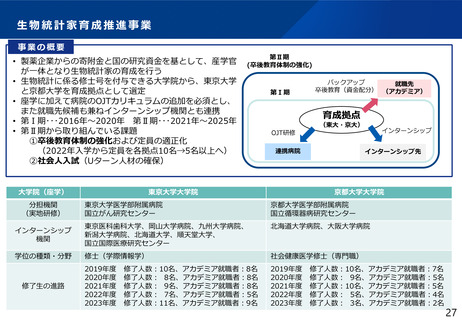
よむ、つかう、まなぶ。
参考資料1:第36回臨床研究部会資料4「臨床研究・治験推進に係る今後の方向性について」 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「国内外の治験をとりまく環境に係る最新の動向調査研究」
令和4年度厚生労働科学特別研究事業 研究代表者:国立がん研究センター東病院臨床研究支援部門長 佐藤暁洋
結果と考察
治験のCost, Speed, Qualityについては、Qualityは従前から問題なく、Speedは改善傾向にあるが、Costについて
はいくつかの課題が残っていることが示唆された。
Costの問題としては、CRA費用等に関しては、Central IRBが普及していないことや医療機関側の電子化が遅れてい
ることに起因する治験依頼者側の事務作業量の増加がcostを海外に比べて押し上げていると考えられた。また、一部
には ICH-GCPとJ-GCPとの違いに起因する制度上の違いもあると考えられる。
医療機関費用に関しては、海外では一般的に用いられているFMV/BMCが日本ではまだテスト導入段階にあること
がわかった。FMV/BMCは透明性確保の観点も含めて、今後は日本でも外資系企業を中心に導入が進んでいくことが
予想されるが、導入には施設側にも大きな負担がかかることが予想される。
Costを改善するKey Factorとしては、Central IRBの導入によって、集約化と治験の電子化を同時に進めることが、事
務作業量の低減と電子化システムの導入コストの低減には有効である可能性がある。ただし、医療機関側と治験依頼
者側のインセンティブに不均衡があり、医療機関側にどのようにインセンティブを付与するかが一つの課題ではない
かと考えられた。
その他、COVID-19の影響、感染症領域での治験、治験情報へのアクセス、海外治験ネットワーク事例、治験DXな
どについても検討・考察している。
結論
以前のドラックラグ解消には、日本の施設が国際共同治験に参加できるまでにレベルアップさせていくことに重点
が置かれ成果を上げたと考えられるが、ドラックロスではレベルを維持したままより効率性を高めることが国際競争
力の観点では重要であると考えられた。
その方策としては、Central IRBやFMV/BMC※、治験の電子化/DXなどが重要であると考えられる。また、治験の
電子化/DXなどは、COVID-19パンデミック下のような状況での治験環境のレジリエンス向上にも重要である。
※
Fair Market Value に基づく Bench Mark Cost 型費用算定
Fair Market Value(CFR定義)「適切に情報が開示され,当事者間で独立性や競争性が十分に確保された条件の下,買い手と売り手
との間で誠実な交渉の結果としてもたらされた,市場価格に基づく価格」
8
令和4年度厚生労働科学特別研究事業 研究代表者:国立がん研究センター東病院臨床研究支援部門長 佐藤暁洋
結果と考察
治験のCost, Speed, Qualityについては、Qualityは従前から問題なく、Speedは改善傾向にあるが、Costについて
はいくつかの課題が残っていることが示唆された。
Costの問題としては、CRA費用等に関しては、Central IRBが普及していないことや医療機関側の電子化が遅れてい
ることに起因する治験依頼者側の事務作業量の増加がcostを海外に比べて押し上げていると考えられた。また、一部
には ICH-GCPとJ-GCPとの違いに起因する制度上の違いもあると考えられる。
医療機関費用に関しては、海外では一般的に用いられているFMV/BMCが日本ではまだテスト導入段階にあること
がわかった。FMV/BMCは透明性確保の観点も含めて、今後は日本でも外資系企業を中心に導入が進んでいくことが
予想されるが、導入には施設側にも大きな負担がかかることが予想される。
Costを改善するKey Factorとしては、Central IRBの導入によって、集約化と治験の電子化を同時に進めることが、事
務作業量の低減と電子化システムの導入コストの低減には有効である可能性がある。ただし、医療機関側と治験依頼
者側のインセンティブに不均衡があり、医療機関側にどのようにインセンティブを付与するかが一つの課題ではない
かと考えられた。
その他、COVID-19の影響、感染症領域での治験、治験情報へのアクセス、海外治験ネットワーク事例、治験DXな
どについても検討・考察している。
結論
以前のドラックラグ解消には、日本の施設が国際共同治験に参加できるまでにレベルアップさせていくことに重点
が置かれ成果を上げたと考えられるが、ドラックロスではレベルを維持したままより効率性を高めることが国際競争
力の観点では重要であると考えられた。
その方策としては、Central IRBやFMV/BMC※、治験の電子化/DXなどが重要であると考えられる。また、治験の
電子化/DXなどは、COVID-19パンデミック下のような状況での治験環境のレジリエンス向上にも重要である。
※
Fair Market Value に基づく Bench Mark Cost 型費用算定
Fair Market Value(CFR定義)「適切に情報が開示され,当事者間で独立性や競争性が十分に確保された条件の下,買い手と売り手
との間で誠実な交渉の結果としてもたらされた,市場価格に基づく価格」
8