よむ、つかう、まなぶ。
参考資料1:第36回臨床研究部会資料4「臨床研究・治験推進に係る今後の方向性について」 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
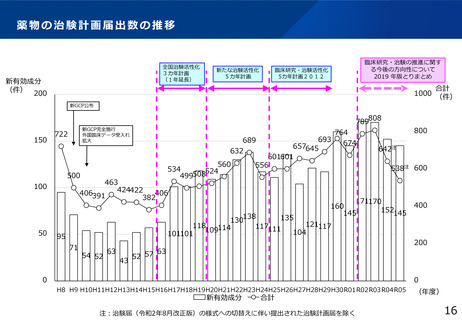
「臨床研究・治験の推進に関する今後の方向性について
これまでの取組
2019年版とりまとめ」
その他の事項
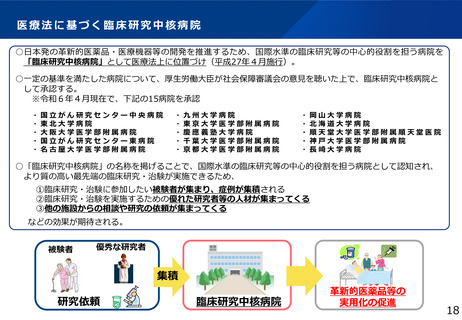
⚫ 認定臨床研究審査委員会(CRB)の質の平準化等として、
・CRB毎の審査の均質化や質の向上を目的として、臨床研究中核病院を中心としたCRBを対象に、
相互にCRBの審議内容を評価し合う相互評価を順次実施
・臨床研究・治験を倫理的及び科学的観点から適正に審査することができる臨床研究・治験の審
査委員会委員及び委員長を養成するための研修を実施
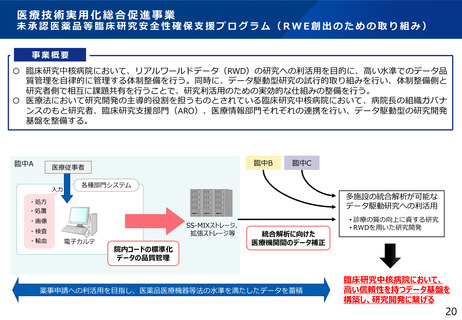
⚫ 特定臨床研究の結果の薬事活用として、
・特定臨床研究で得られたデータを薬事申請に活用する場合の要件、留意点等を一例として取り
まとめ、事務連絡を発出(令和5年3月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡、令
和6年6月5日厚生労働省医薬局医療機器審査管理課事務連絡)
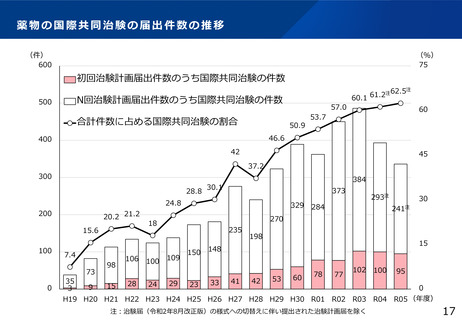
⚫ 国際共同臨床試験の体制整備として、
・臨床研究中核病院において、海外対応可能な人材の育成や、国際共同治験を実施する者に対す
る支援を行うとともに、国際共同治験の推進に資するノウハウ共有を実施
・日本とアジア諸外国が連携し、臨床試験実施拠点のネットワークの構築を図るための基盤整備
を実施
7
これまでの取組
2019年版とりまとめ」
その他の事項
⚫ 認定臨床研究審査委員会(CRB)の質の平準化等として、
・CRB毎の審査の均質化や質の向上を目的として、臨床研究中核病院を中心としたCRBを対象に、
相互にCRBの審議内容を評価し合う相互評価を順次実施
・臨床研究・治験を倫理的及び科学的観点から適正に審査することができる臨床研究・治験の審
査委員会委員及び委員長を養成するための研修を実施
⚫ 特定臨床研究の結果の薬事活用として、
・特定臨床研究で得られたデータを薬事申請に活用する場合の要件、留意点等を一例として取り
まとめ、事務連絡を発出(令和5年3月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡、令
和6年6月5日厚生労働省医薬局医療機器審査管理課事務連絡)
⚫ 国際共同臨床試験の体制整備として、
・臨床研究中核病院において、海外対応可能な人材の育成や、国際共同治験を実施する者に対す
る支援を行うとともに、国際共同治験の推進に資するノウハウ共有を実施
・日本とアジア諸外国が連携し、臨床試験実施拠点のネットワークの構築を図るための基盤整備
を実施
7