よむ、つかう、まなぶ。
資料1-1:EFPIA/PhRMA/日本製薬工業協会 提出資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
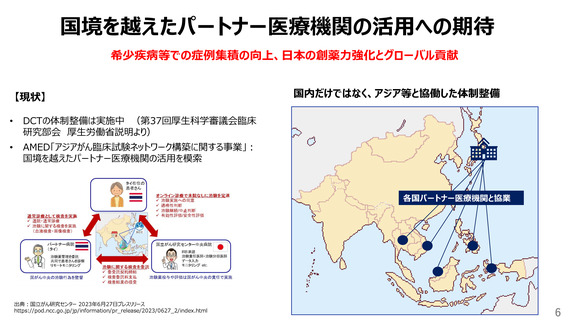
英語資料の受け入れ・共通言語化
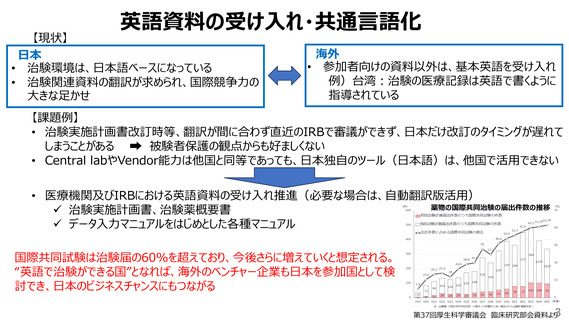
【現状】
日本
• 治験環境は、日本語ベースになっている
• 治験関連資料の翻訳が求められ、国際競争力の
大きな足かせ
海外
• 参加者向けの資料以外は、基本英語を受け入れ
例)台湾:治験の医療記録は英語で書くように
指導されている
【課題例】
• 治験実施計画書改訂時等、翻訳が間に合わず直近のIRBで審議ができず、日本だけ改訂のタイミングが遅れて
しまうことがある
被験者保護の観点からも好ましくない
• Central labやVendor能力は他国と同等であっても、日本独自のツール(日本語)は、他国で活用できない
• 医療機関及びIRBにおける英語資料の受け入れ推進(必要な場合は、自動翻訳版活用)
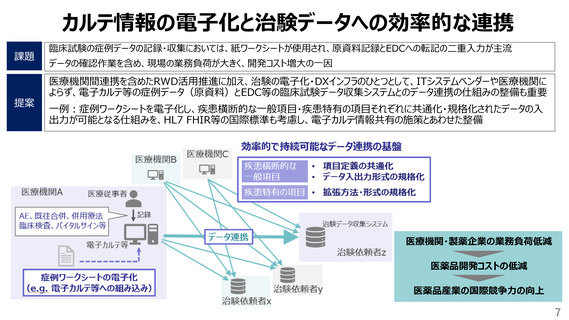
薬物の国際共同治験の届出件数の推移
✓ 治験実施計画書、治験薬概要書
✓ データ入力マニュアルをはじめとした各種マニュアル
国際共同試験は治験届の60%を超えており、今後さらに増えていくと想定される。
“英語で治験ができる国”となれば、海外のベンチャー企業も日本を参加国として検
討でき、日本のビジネスチャンスにもつながる
第37回厚生科学審議会 臨床研究部会資料より3
【現状】
日本
• 治験環境は、日本語ベースになっている
• 治験関連資料の翻訳が求められ、国際競争力の
大きな足かせ
海外
• 参加者向けの資料以外は、基本英語を受け入れ
例)台湾:治験の医療記録は英語で書くように
指導されている
【課題例】
• 治験実施計画書改訂時等、翻訳が間に合わず直近のIRBで審議ができず、日本だけ改訂のタイミングが遅れて
しまうことがある
被験者保護の観点からも好ましくない
• Central labやVendor能力は他国と同等であっても、日本独自のツール(日本語)は、他国で活用できない
• 医療機関及びIRBにおける英語資料の受け入れ推進(必要な場合は、自動翻訳版活用)
薬物の国際共同治験の届出件数の推移
✓ 治験実施計画書、治験薬概要書
✓ データ入力マニュアルをはじめとした各種マニュアル
国際共同試験は治験届の60%を超えており、今後さらに増えていくと想定される。
“英語で治験ができる国”となれば、海外のベンチャー企業も日本を参加国として検
討でき、日本のビジネスチャンスにもつながる
第37回厚生科学審議会 臨床研究部会資料より3