よむ、つかう、まなぶ。
資料1-1:EFPIA/PhRMA/日本製薬工業協会 提出資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
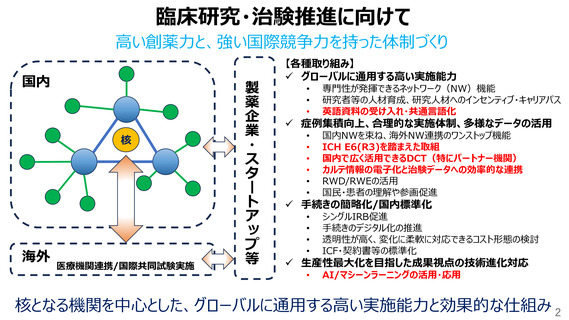
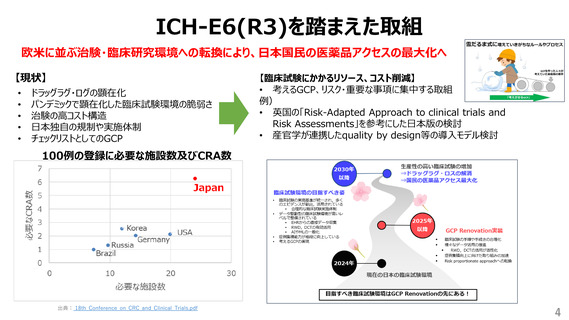
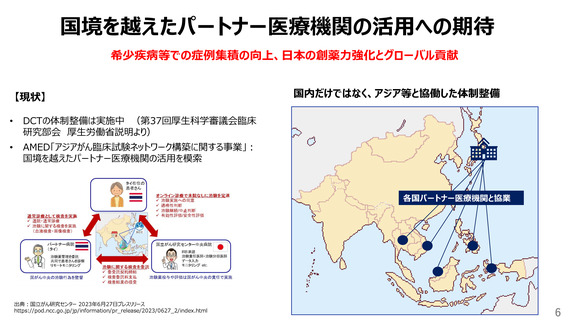
ICH-E6(R3)を踏まえた取組
欧米に並ぶ治験・臨床研究環境への転換により、日本国民の医薬品アクセスの最大化へ
【現状】
•
•
•
•
•
ドラッグラグ・ログの顕在化
パンデミックで顕在化した臨床試験環境の脆弱さ
治験の高コスト構造
日本独自の規制や実施体制
チェックリストとしてのGCP
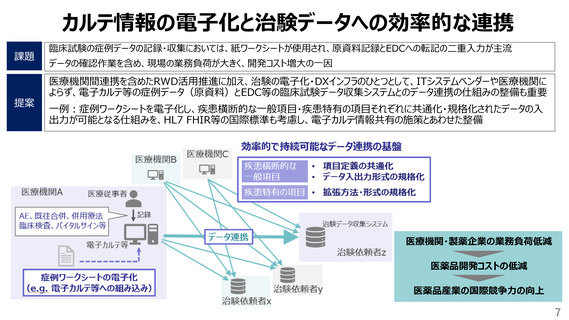
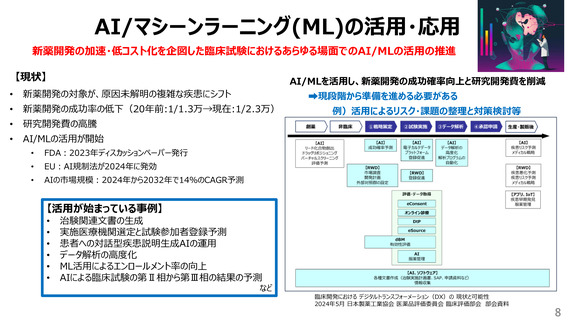
【臨床試験にかかるリソース、コスト削減】
• 考えるGCP、リスク・重要な事項に集中する取組
例)
• 英国の「Risk-Adapted Approach to clinical trials and
Risk Assessments」を参考にした日本版の検討
• 産官学が連携したquality by design等の導入モデル検討
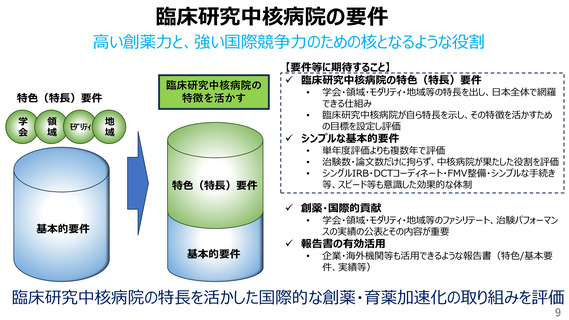
100例の登録に必要な施設数及びCRA数
出典: 18th_Conference_on_CRC_and_Clinical_Trials.pdf
4
欧米に並ぶ治験・臨床研究環境への転換により、日本国民の医薬品アクセスの最大化へ
【現状】
•
•
•
•
•
ドラッグラグ・ログの顕在化
パンデミックで顕在化した臨床試験環境の脆弱さ
治験の高コスト構造
日本独自の規制や実施体制
チェックリストとしてのGCP
【臨床試験にかかるリソース、コスト削減】
• 考えるGCP、リスク・重要な事項に集中する取組
例)
• 英国の「Risk-Adapted Approach to clinical trials and
Risk Assessments」を参考にした日本版の検討
• 産官学が連携したquality by design等の導入モデル検討
100例の登録に必要な施設数及びCRA数
出典: 18th_Conference_on_CRC_and_Clinical_Trials.pdf
4