よむ、つかう、まなぶ。
資料1-1:EFPIA/PhRMA/日本製薬工業協会 提出資料 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
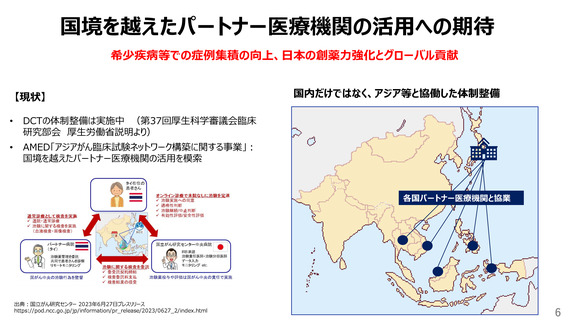
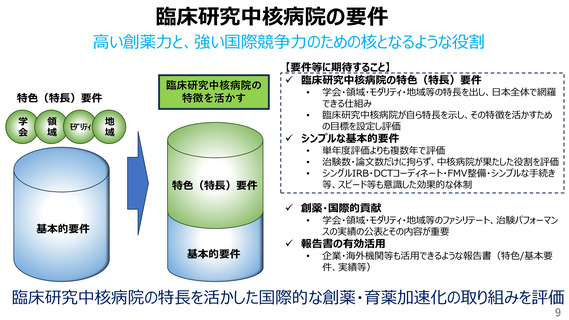
臨床研究中核病院の要件
高い創薬力と、強い国際競争力のための核となるような役割
臨床研究中核病院の
特徴を活かす
特色(特長)要件
学
会
領
域
モダリティ
【要件等に期待すること】
✓ 臨床研究中核病院の特色(特長)要件
•
•
地
域
学会・領域・モダリティ・地域等の特長を出し、日本全体で網羅
できる仕組み
臨床研究中核病院が自ら特長を示し、その特徴を活かすため
の目標を設定し評価
✓ シンプルな基本的要件
特色(特長)要件
•
•
•
単年度評価よりも複数年で評価
治験数・論文数だけに拘らず、中核病院が果たした役割を評価
シングルIRB・DCTコーディネート・FMV整備・シンプルな手続き
等、スピード等も意識した効果的な体制
✓ 創薬・国際的貢献
•
基本的要件
基本的要件
学会・領域・モダリティ・地域等のファシリテート、治験パフォーマン
スの実績の公表とその内容が重要
✓ 報告書の有効活用
•
企業・海外機関等も活用できるような報告書(特色/基本要
件、実績等)
臨床研究中核病院の特長を活かした国際的な創薬・育薬加速化の取り組みを評価
9
高い創薬力と、強い国際競争力のための核となるような役割
臨床研究中核病院の
特徴を活かす
特色(特長)要件
学
会
領
域
モダリティ
【要件等に期待すること】
✓ 臨床研究中核病院の特色(特長)要件
•
•
地
域
学会・領域・モダリティ・地域等の特長を出し、日本全体で網羅
できる仕組み
臨床研究中核病院が自ら特長を示し、その特徴を活かすため
の目標を設定し評価
✓ シンプルな基本的要件
特色(特長)要件
•
•
•
単年度評価よりも複数年で評価
治験数・論文数だけに拘らず、中核病院が果たした役割を評価
シングルIRB・DCTコーディネート・FMV整備・シンプルな手続き
等、スピード等も意識した効果的な体制
✓ 創薬・国際的貢献
•
基本的要件
基本的要件
学会・領域・モダリティ・地域等のファシリテート、治験パフォーマン
スの実績の公表とその内容が重要
✓ 報告書の有効活用
•
企業・海外機関等も活用できるような報告書(特色/基本要
件、実績等)
臨床研究中核病院の特長を活かした国際的な創薬・育薬加速化の取り組みを評価
9