よむ、つかう、まなぶ。
総-2参考4 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
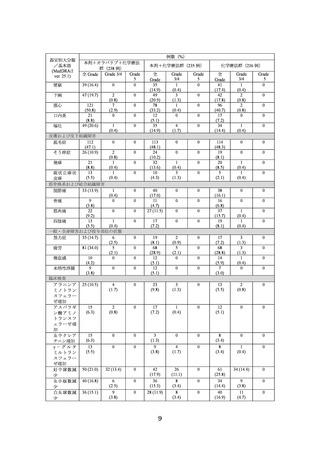
3.臨床成績
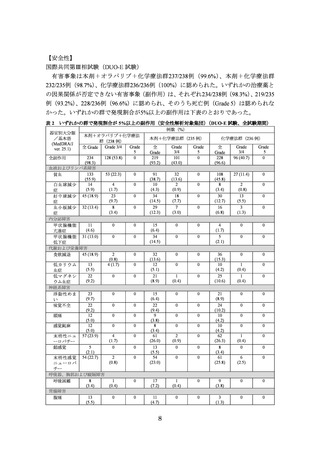
【有効性】
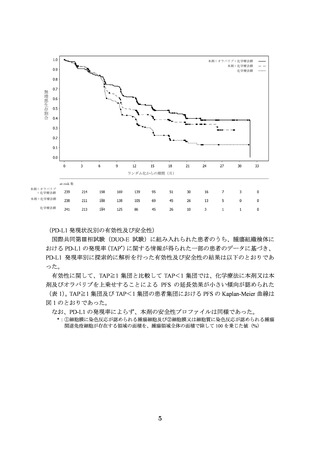
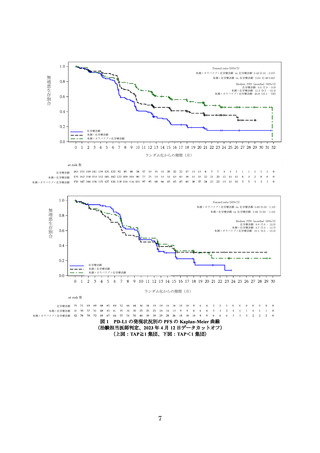
国際共同第Ⅲ相試験(DUO-E 試験)
化学療法歴のない*1 進行・再発の子宮体癌患者*2 718 例(①本剤+オラパリブ+化学
療法*3 群 239 例、②本剤+化学療法*3 群 238 例、③化学療法*3 群 241 例)
(日本人 88 例
[それぞれ①26 例、②30 例、③32 例])を対象に、上記①及び②と③の有効性及び安全
性を検討した。
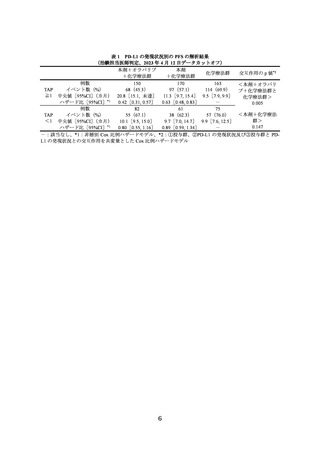
主要評価項目とされた RECIST ver.1.1 に基づく治験担当医師判定による無増悪生存
期間(以下、
「PFS」
)
(中央値[95%信頼区間(以下、
「CI」)
])の結果は、本剤+オラパ
リブ+化学療法群で 15.1、本剤+化学療法群で 10.2、化学療法群で 9.6 カ月であり、本
剤+オラパリブ+化学療法及び本剤+化学療法は化学療法に対して統計学的に有意な
延長を示した(①化学療法群に対する本剤+オラパリブ+化学療法群のハザード比
[95%CI]
:0.55[0.43~0.69]、p<0.0001[層別 log-rank 検定]
、有意水準(両側)0.025、
②化学療法群に対する本剤+化学療法群のハザード比[95%CI]
:0.71[0.57~0.89]
、p
=0.003[層別 log-rank 検定、有意水準(両側)0.025、2023 年 4 月 12 日データカットオ
フ)。
*1:術前又は術後の補助療法として抗悪性腫瘍剤が投与された場合には、抗悪性腫瘍剤の最終投与日
から再発までの期間が 12 カ月間以上の患者が対象とされた。
*2:以下のいずれかに該当する患者が対象とされた。
➢ International Federation of Gynecology and Obstetrics(以下、
「FIGO」
)分類(2009 年版)Ⅲ期の
患者のうち、手術又は生検後に RECIST ver.1.1 に基づく測定可能病変が認められた患者
➢ FIGO 分類(2009 年版)Ⅳ期の患者(手術又は生検後の残存病変の有無は問わない)
➢ 手術を含む治療により根治する可能性が低い再発の患者
*3:用法・用量は以下のとおりとされた。
投与群
化学療法併用期
維持療法期
CBDCA/PTX†1、2 との併
本剤+オラパリブ
本剤 1,500 mg を Q4W で静脈内投与
用で、本剤 1,120 mg を
+化学療法群
オラパリブ 300 mg を BID 経口投与
Q3W で静脈内投与†3
CBDCA/PTX†1、2 との併
本剤 1,500 mg を Q4W で静脈内投与
本剤+化学療法群
用で、本剤 1,120 mg を
オラパリブのプラセボを BID 経口投与
Q3W で静脈内投与†3
CBDCA/PTX†1、2 との併
本剤のプラセボを Q4W で静脈内投与
化学療法群
用で、プラセボを Q3W
オラパリブのプラセボを BID 経口投与
†3
で静脈内投与
CBDCA:カルボプラチン、PTX:パクリタキセル、CBDCA/PTX:CBDCA と PTX との併用、
Q3W:3 週間間隔、Q4W:4 週間間隔、BID:1 日 2 回、†1:CBDCA AUC5 又は 6 mg・min/mL
相当量及び PTX 175 mg/m2 を Q3W で静脈内投与、†2:CBDCA/PTX 投与による過敏症反応が
発現した場合等には、①CBDCA 及び②PTX をそれぞれ①シスプラチン及び②パクリタキセル
(アルブミン懸濁型)又はドセタキセル水和物に変更可能とされた、†3:最大 6 回投与
4
【有効性】
国際共同第Ⅲ相試験(DUO-E 試験)
化学療法歴のない*1 進行・再発の子宮体癌患者*2 718 例(①本剤+オラパリブ+化学
療法*3 群 239 例、②本剤+化学療法*3 群 238 例、③化学療法*3 群 241 例)
(日本人 88 例
[それぞれ①26 例、②30 例、③32 例])を対象に、上記①及び②と③の有効性及び安全
性を検討した。
主要評価項目とされた RECIST ver.1.1 に基づく治験担当医師判定による無増悪生存
期間(以下、
「PFS」
)
(中央値[95%信頼区間(以下、
「CI」)
])の結果は、本剤+オラパ
リブ+化学療法群で 15.1、本剤+化学療法群で 10.2、化学療法群で 9.6 カ月であり、本
剤+オラパリブ+化学療法及び本剤+化学療法は化学療法に対して統計学的に有意な
延長を示した(①化学療法群に対する本剤+オラパリブ+化学療法群のハザード比
[95%CI]
:0.55[0.43~0.69]、p<0.0001[層別 log-rank 検定]
、有意水準(両側)0.025、
②化学療法群に対する本剤+化学療法群のハザード比[95%CI]
:0.71[0.57~0.89]
、p
=0.003[層別 log-rank 検定、有意水準(両側)0.025、2023 年 4 月 12 日データカットオ
フ)。
*1:術前又は術後の補助療法として抗悪性腫瘍剤が投与された場合には、抗悪性腫瘍剤の最終投与日
から再発までの期間が 12 カ月間以上の患者が対象とされた。
*2:以下のいずれかに該当する患者が対象とされた。
➢ International Federation of Gynecology and Obstetrics(以下、
「FIGO」
)分類(2009 年版)Ⅲ期の
患者のうち、手術又は生検後に RECIST ver.1.1 に基づく測定可能病変が認められた患者
➢ FIGO 分類(2009 年版)Ⅳ期の患者(手術又は生検後の残存病変の有無は問わない)
➢ 手術を含む治療により根治する可能性が低い再発の患者
*3:用法・用量は以下のとおりとされた。
投与群
化学療法併用期
維持療法期
CBDCA/PTX†1、2 との併
本剤+オラパリブ
本剤 1,500 mg を Q4W で静脈内投与
用で、本剤 1,120 mg を
+化学療法群
オラパリブ 300 mg を BID 経口投与
Q3W で静脈内投与†3
CBDCA/PTX†1、2 との併
本剤 1,500 mg を Q4W で静脈内投与
本剤+化学療法群
用で、本剤 1,120 mg を
オラパリブのプラセボを BID 経口投与
Q3W で静脈内投与†3
CBDCA/PTX†1、2 との併
本剤のプラセボを Q4W で静脈内投与
化学療法群
用で、プラセボを Q3W
オラパリブのプラセボを BID 経口投与
†3
で静脈内投与
CBDCA:カルボプラチン、PTX:パクリタキセル、CBDCA/PTX:CBDCA と PTX との併用、
Q3W:3 週間間隔、Q4W:4 週間間隔、BID:1 日 2 回、†1:CBDCA AUC5 又は 6 mg・min/mL
相当量及び PTX 175 mg/m2 を Q3W で静脈内投与、†2:CBDCA/PTX 投与による過敏症反応が
発現した場合等には、①CBDCA 及び②PTX をそれぞれ①シスプラチン及び②パクリタキセル
(アルブミン懸濁型)又はドセタキセル水和物に変更可能とされた、†3:最大 6 回投与
4