よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
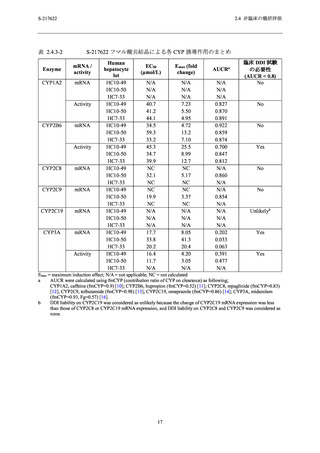
参照) との比
ラット中枢神経系への作用を評価する試験 (2.6.2.4.1.1 項参照) では,1000 mg/kg の用量まで
中枢神経系への影響を示唆する変化はなく,無影響量は 1000 mg/kg と判断した.ラットへの単
回経口投与時の中枢神経系に対する無影響量における Cmax と申請用法用量の Cmax (28.1 µg/mL)
との比は 10.5 倍であった (表 2.4.2-2).
ヒト ether-à-go-go 関連遺伝子 (hERG) 導入細胞におけるカリウム電流に対する作用試験にお
いて,hERG 電流に対する IC50 は 100 µmol/L (53.2 µg/mL) を超える濃度と推定された.また,
サル心血管系及び呼吸系への作用を評価する試験では,50 及び 150 mg/kg の用量で軽度な心拍
数の増加が認められたが,150 mg/kg の用量まで血圧,心電図,呼吸数及び血液ガスパラメータ
に影響は認められなかった.サルへの S-217622 フマル酸共結晶は単回経口投与時の心血管系に
対する無影響量 (10 mg/kg) 及び呼吸系に対する無影響量 (150 mg/kg) における Cmax と,申請
用法用量の Cmax (第 1 相試験 [T1211 試験] の 375/125 mg 投与 5 日目の Cmax;28.1 µg/mL)との
比はそれぞれ 1.6 又は 11.6 倍であった (表 2.4.4-2).なお,第 1 相及び 2/3 相試験において
S-217622 フマル酸共結晶投与に起因した中枢神経系,心血管系及び呼吸系への影響を示唆する
有害事象は現時点では認められていない (2.5.5.2 項参照).
以上の安全性薬理試験の結果から,本剤の申請用法用量において,中枢神経系,心血管系及
び呼吸系に関して,重篤な有害事象が生じる可能性は低いと考えられる.
2.4.3
薬物動態試験
S-217622 フマル酸共結晶の薬物動態試験は,薬理試験及び毒性試験あるいはいずれかの試験
で用いたマウス,ラット,ウサギ及びサルを用いて実施した.
S-217622 フマル酸共結晶のラットにおけるバイオアベイラビリティ (BA) は 85.5% (2.6.4.3.1
項参照),尿及び胆汁排泄率の和から推定される吸収率は,ラットで約 64% (2.6.4.6.1.1 項参照),
サルで約 74% (2.6.4.6.2 項参照) であることから,S-217622 フマル酸共結晶は高い経口吸収性を
示した.薬理試験で S-217622 フマル酸共結晶を感染マウス (投与量:2~64 mg/kg) に単回経口
投与したとき,並びに反復経口投与毒性試験で S-217622 フマル酸共結晶をラット (投与量:20
~100 mg/kg),ウサギ (投与量:30~100 mg/kg) 及びサル (投与量:3~50 mg/kg) に 1 日 1 回反
復経口投与したときの投与 1 日目の血漿中 S-217622 の Cmax 及び AUC0-24hr は,用量に比例して
増大し,
上記用量範囲で S-217622 の体内動態は線形であることが示された (2.6.4.3.3 項,
2.6.4.3.4
項,2.6.4.3.5 項及び 2.6.4.3.6 項参照).また,反復経口投与毒性試験でのトキシコキネティクス
(TK) より,ラット及びサルの両種において,血漿中 S-217622 の Cmax 及び AUC0-24hr に性差はみ
られなかった.さらに,反復経口投与により血漿中 S-217622 の Cmax 及び AUC0-24hr は増加する
傾向が認められたが,ラット,ウサギ及びサルのいずれも高用量 (ラット:1000 mg/kg/日,ウサ
ギ:300 mg/kg/日,サル雄:1000/300/100 mg/kg/日 [投与 3 日目に 1000 mg/kg/日から 300 mg/kg/
日,投与 8 日目に 300 mg/kg/日から 100 mg/kg/日に減量],サル雌:300/100 mg/kg/日 [投与 9 日
目に 300 mg/kg/日から 100 mg/kg/日に減量]) では,投与 1 日目と比べて同等あるいは低下する
傾向がみられた.
13
2.4 非臨床の概括評価
参照) との比
ラット中枢神経系への作用を評価する試験 (2.6.2.4.1.1 項参照) では,1000 mg/kg の用量まで
中枢神経系への影響を示唆する変化はなく,無影響量は 1000 mg/kg と判断した.ラットへの単
回経口投与時の中枢神経系に対する無影響量における Cmax と申請用法用量の Cmax (28.1 µg/mL)
との比は 10.5 倍であった (表 2.4.2-2).
ヒト ether-à-go-go 関連遺伝子 (hERG) 導入細胞におけるカリウム電流に対する作用試験にお
いて,hERG 電流に対する IC50 は 100 µmol/L (53.2 µg/mL) を超える濃度と推定された.また,
サル心血管系及び呼吸系への作用を評価する試験では,50 及び 150 mg/kg の用量で軽度な心拍
数の増加が認められたが,150 mg/kg の用量まで血圧,心電図,呼吸数及び血液ガスパラメータ
に影響は認められなかった.サルへの S-217622 フマル酸共結晶は単回経口投与時の心血管系に
対する無影響量 (10 mg/kg) 及び呼吸系に対する無影響量 (150 mg/kg) における Cmax と,申請
用法用量の Cmax (第 1 相試験 [T1211 試験] の 375/125 mg 投与 5 日目の Cmax;28.1 µg/mL)との
比はそれぞれ 1.6 又は 11.6 倍であった (表 2.4.4-2).なお,第 1 相及び 2/3 相試験において
S-217622 フマル酸共結晶投与に起因した中枢神経系,心血管系及び呼吸系への影響を示唆する
有害事象は現時点では認められていない (2.5.5.2 項参照).
以上の安全性薬理試験の結果から,本剤の申請用法用量において,中枢神経系,心血管系及
び呼吸系に関して,重篤な有害事象が生じる可能性は低いと考えられる.
2.4.3
薬物動態試験
S-217622 フマル酸共結晶の薬物動態試験は,薬理試験及び毒性試験あるいはいずれかの試験
で用いたマウス,ラット,ウサギ及びサルを用いて実施した.
S-217622 フマル酸共結晶のラットにおけるバイオアベイラビリティ (BA) は 85.5% (2.6.4.3.1
項参照),尿及び胆汁排泄率の和から推定される吸収率は,ラットで約 64% (2.6.4.6.1.1 項参照),
サルで約 74% (2.6.4.6.2 項参照) であることから,S-217622 フマル酸共結晶は高い経口吸収性を
示した.薬理試験で S-217622 フマル酸共結晶を感染マウス (投与量:2~64 mg/kg) に単回経口
投与したとき,並びに反復経口投与毒性試験で S-217622 フマル酸共結晶をラット (投与量:20
~100 mg/kg),ウサギ (投与量:30~100 mg/kg) 及びサル (投与量:3~50 mg/kg) に 1 日 1 回反
復経口投与したときの投与 1 日目の血漿中 S-217622 の Cmax 及び AUC0-24hr は,用量に比例して
増大し,
上記用量範囲で S-217622 の体内動態は線形であることが示された (2.6.4.3.3 項,
2.6.4.3.4
項,2.6.4.3.5 項及び 2.6.4.3.6 項参照).また,反復経口投与毒性試験でのトキシコキネティクス
(TK) より,ラット及びサルの両種において,血漿中 S-217622 の Cmax 及び AUC0-24hr に性差はみ
られなかった.さらに,反復経口投与により血漿中 S-217622 の Cmax 及び AUC0-24hr は増加する
傾向が認められたが,ラット,ウサギ及びサルのいずれも高用量 (ラット:1000 mg/kg/日,ウサ
ギ:300 mg/kg/日,サル雄:1000/300/100 mg/kg/日 [投与 3 日目に 1000 mg/kg/日から 300 mg/kg/
日,投与 8 日目に 300 mg/kg/日から 100 mg/kg/日に減量],サル雌:300/100 mg/kg/日 [投与 9 日
目に 300 mg/kg/日から 100 mg/kg/日に減量]) では,投与 1 日目と比べて同等あるいは低下する
傾向がみられた.
13