よむ、つかう、まなぶ。
総-5-1○最適使用推進ガイドラインについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00161.html |
| 出典情報 | 中央社会保険医療協議会 総会(第529回 10/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.
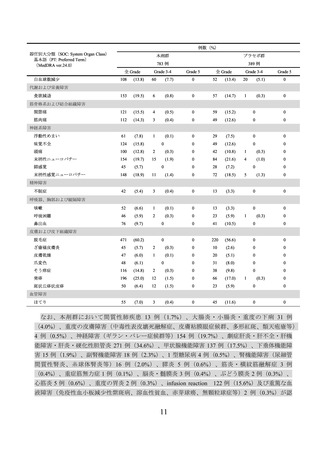
臨床成績
PD-L1 陽性のホルモン受容体陰性かつヒト上皮細胞増殖因子受容体 2(以下「HER2」と
いう。)陰性の手術不能又は再発乳癌及びホルモン受容体陰性かつ HER2 陰性で再発高リ
スクの乳癌における術前・術後薬物療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
①国際共同第Ⅲ相試験(KEYNOTE-355 試験パート 2)
転移・再発乳癌に対する全身性の前治療歴のないホルモン受容体陰性かつ HER2 陰
性の手術不能又は再発乳癌患者 847 例(日本人 87 例を含む)を対象に、本剤 200 mg
3 週間間隔(以下「Q3W」という。)投与+化学療法*1(ゲムシタビン塩酸塩(以下
「ゲムシタビン」という。)及びカルボプラチン、パクリタキセル又はパクリタキセ
ル(アルブミン懸濁型)(以下「nab-パクリタキセル」という。))の併用療法の有
効性及び安全性が、プラセボ+化学療法*2(ゲムシタビン及びカルボプラチン、パク
リタキセル又は nab-パクリタキセル)を対照として検討された。なお、画像評価で疾
患進行が認められた場合に、疾患進行を示す症状が認められない等の臨床的に安定し
ている患者では、次回以降の画像評価で疾患進行が認められるまで本剤の投与を継続
することが可能とされた。主要評価項目は無増悪生存期間(以下「PFS」という。)
及び全生存期間とされ、本剤+化学療法の併用療法はプラセボ+化学療法の併用療法
と比較して、PD-L1 陽性(CPS*3≧10)の患者 323 例(日本人 28 例を含む)において
PFS を有意に延長した(表 1 及び図 1)。
*1:本剤 200 mg Q3W と以下の化学療法(担当医師が患者ごとに選択)を併用した[ゲム
シタビン 1,000 mg/m2 及びカルボプラチン AUC 2 mg・min/mL 相当量(1 コース 21 日
間、各コースの 1、8 日目に投与)、パクリタキセル 90 mg/m2(1 コース 28 日間、各
コースの 1、8、15 日目に投与)又は nab-パクリタキセル 100 mg/m2(1 コース 28 日
間、各コースの 1、8、15 日目に投与)]
*2:プラセボ Q3W と以下の化学療法(担当医師が患者ごとに選択)を併用した[ゲムシ
タビン 1,000 mg/m2 及びカルボプラチン AUC 2 mg・min/mL 相当量(1 コース 21 日
間、各コースの 1、8 日目に投与)、パクリタキセル 90 mg/m2(1 コース 28 日間、各
コースの 1、8、15 日目に投与)又は nab-パクリタキセル 100 mg/m2(1 コース 28 日
間、各コースの 1、8、15 日目に投与)]。
*3:PD-L1 を発現した細胞数(腫瘍細胞、マクロファージ及びリンパ球)を総腫瘍細胞
数で除し、100 を乗じた値
4
臨床成績
PD-L1 陽性のホルモン受容体陰性かつヒト上皮細胞増殖因子受容体 2(以下「HER2」と
いう。)陰性の手術不能又は再発乳癌及びホルモン受容体陰性かつ HER2 陰性で再発高リ
スクの乳癌における術前・術後薬物療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
①国際共同第Ⅲ相試験(KEYNOTE-355 試験パート 2)
転移・再発乳癌に対する全身性の前治療歴のないホルモン受容体陰性かつ HER2 陰
性の手術不能又は再発乳癌患者 847 例(日本人 87 例を含む)を対象に、本剤 200 mg
3 週間間隔(以下「Q3W」という。)投与+化学療法*1(ゲムシタビン塩酸塩(以下
「ゲムシタビン」という。)及びカルボプラチン、パクリタキセル又はパクリタキセ
ル(アルブミン懸濁型)(以下「nab-パクリタキセル」という。))の併用療法の有
効性及び安全性が、プラセボ+化学療法*2(ゲムシタビン及びカルボプラチン、パク
リタキセル又は nab-パクリタキセル)を対照として検討された。なお、画像評価で疾
患進行が認められた場合に、疾患進行を示す症状が認められない等の臨床的に安定し
ている患者では、次回以降の画像評価で疾患進行が認められるまで本剤の投与を継続
することが可能とされた。主要評価項目は無増悪生存期間(以下「PFS」という。)
及び全生存期間とされ、本剤+化学療法の併用療法はプラセボ+化学療法の併用療法
と比較して、PD-L1 陽性(CPS*3≧10)の患者 323 例(日本人 28 例を含む)において
PFS を有意に延長した(表 1 及び図 1)。
*1:本剤 200 mg Q3W と以下の化学療法(担当医師が患者ごとに選択)を併用した[ゲム
シタビン 1,000 mg/m2 及びカルボプラチン AUC 2 mg・min/mL 相当量(1 コース 21 日
間、各コースの 1、8 日目に投与)、パクリタキセル 90 mg/m2(1 コース 28 日間、各
コースの 1、8、15 日目に投与)又は nab-パクリタキセル 100 mg/m2(1 コース 28 日
間、各コースの 1、8、15 日目に投与)]
*2:プラセボ Q3W と以下の化学療法(担当医師が患者ごとに選択)を併用した[ゲムシ
タビン 1,000 mg/m2 及びカルボプラチン AUC 2 mg・min/mL 相当量(1 コース 21 日
間、各コースの 1、8 日目に投与)、パクリタキセル 90 mg/m2(1 コース 28 日間、各
コースの 1、8、15 日目に投与)又は nab-パクリタキセル 100 mg/m2(1 コース 28 日
間、各コースの 1、8、15 日目に投与)]。
*3:PD-L1 を発現した細胞数(腫瘍細胞、マクロファージ及びリンパ球)を総腫瘍細胞
数で除し、100 を乗じた値
4