よむ、つかう、まなぶ。
総-5-1○最適使用推進ガイドラインについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
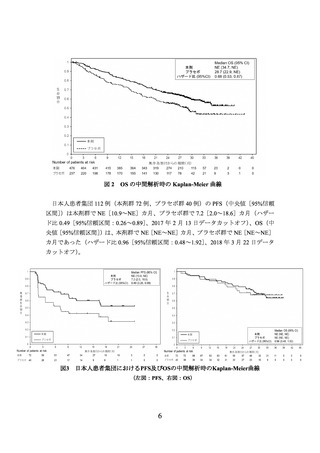
② 国際共同第Ⅲ相試験(POSEIDON 試験)
化 学 療 法 歴 の な い 切 除 不 能 な 進 行 ・ 再 発 の 非 小 細 胞 肺 癌 患 者 *1 ( WHO/ECOG
Performance Status 0 又は 1)675 例(本剤*2+トレメリムマブ(遺伝子組換え)(以下、
「トレメリムマブ」)*2+白金製剤を含む化学療法*3[本剤併用群 338 例]、白金製剤を含
む化学療法*3 単独[対照群 337 例]
(日本人 49 例[本剤併用群 21 例、対照群 28 例]を
含む)を対象に、本剤、トレメリムマブ及び白金製剤を含む化学療法を併用投与した場
合の有効性及び安全性を検討した。
OS(中央値[95%信頼区間])
(536 件のイベント)の結果は、本剤併用群で 14.0(11.7
~16.1)カ月、対照群で 11.7(10.5~13.1)カ月であり、本剤併用群は対照群に対し統計
学的に有意な延長を示した(ハザード比[95%信頼区間]
:0.77[0.650~0.916]、p=0.00304
[層別 log-rank 検定、有意水準(両側)0.00797]
、2021 年 3 月 12 日データカットオフ)。
*1:体重 30 kg 超であり、上皮増殖因子受容体(以下、
「EGFR」
)遺伝子変異陰性かつ未分化リンパ腫
キナーゼ(以下、
「ALK」
)融合遺伝子陰性の患者が対象とされた。ただし、扁平上皮非小細胞肺癌
患者又は Kirsten ラット肉腫ウイルス癌遺伝子ホモログ(KRAS)遺伝子変異陽性の患者は EGFR 遺
伝子変異及び ALK 融合遺伝子変異の検査を実施しないことが許容された。
*2:本剤 1500 mg 及びトレメリムマブ 75 mg を第 0、3、6、9 週目に各 1 回投与し、その後第 12 週目
から本剤 1500 mg を 4 週間間隔で投与した。また、第 16 週目にトレメリムマブ 75 mg を 1 回投与
した。
*3:3 週間を 1 サイクルとして、①パクリタキセル(アルブミン懸濁型)
(第 1、8、15 日目に 100 mg/m2
を投与)+カルボプラチン(第 1 日目に AUC 5 又は 6 を投与)
、②ゲムシタビン(第 1、8 日目に
1,000 mg/m2 又は 1,250 mg/m2 を投与)+シスプラチン(第 1 日目に 75 mg/m2 を投与)若しくはカ
ルボプラチン(第 1 日目に AUC 5 又は 6 を投与)
(扁平上皮癌のみ)
、又は③ペメトレキセド(第
1 日目に 500 mg/m2 を投与)+シスプラチン(第 1 日目に 75 mg/m2 を投与)若しくはカルボプラ
チン(第 1 日目に AUC 5 又は 6 を投与)
(非扁平上皮癌のみ)のいずれかを 4 サイクル投与した。
対照群では、必要と判断された場合さらに 2 サイクルまで追加可とした。③ペメトレキセド+白
金製剤投与後に病勢が進行していない患者は、ペメトレキセド(500 mg/m2)維持療法(本剤併用
群では 4 週間間隔投与、対照群では 3 週間又は 4 週間間隔投与)に移行した。
図 6 OS の Kaplan-Meier 曲線
8
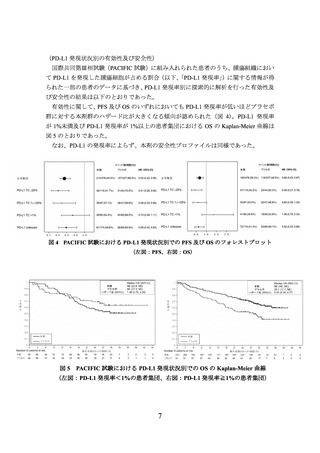
化 学 療 法 歴 の な い 切 除 不 能 な 進 行 ・ 再 発 の 非 小 細 胞 肺 癌 患 者 *1 ( WHO/ECOG
Performance Status 0 又は 1)675 例(本剤*2+トレメリムマブ(遺伝子組換え)(以下、
「トレメリムマブ」)*2+白金製剤を含む化学療法*3[本剤併用群 338 例]、白金製剤を含
む化学療法*3 単独[対照群 337 例]
(日本人 49 例[本剤併用群 21 例、対照群 28 例]を
含む)を対象に、本剤、トレメリムマブ及び白金製剤を含む化学療法を併用投与した場
合の有効性及び安全性を検討した。
OS(中央値[95%信頼区間])
(536 件のイベント)の結果は、本剤併用群で 14.0(11.7
~16.1)カ月、対照群で 11.7(10.5~13.1)カ月であり、本剤併用群は対照群に対し統計
学的に有意な延長を示した(ハザード比[95%信頼区間]
:0.77[0.650~0.916]、p=0.00304
[層別 log-rank 検定、有意水準(両側)0.00797]
、2021 年 3 月 12 日データカットオフ)。
*1:体重 30 kg 超であり、上皮増殖因子受容体(以下、
「EGFR」
)遺伝子変異陰性かつ未分化リンパ腫
キナーゼ(以下、
「ALK」
)融合遺伝子陰性の患者が対象とされた。ただし、扁平上皮非小細胞肺癌
患者又は Kirsten ラット肉腫ウイルス癌遺伝子ホモログ(KRAS)遺伝子変異陽性の患者は EGFR 遺
伝子変異及び ALK 融合遺伝子変異の検査を実施しないことが許容された。
*2:本剤 1500 mg 及びトレメリムマブ 75 mg を第 0、3、6、9 週目に各 1 回投与し、その後第 12 週目
から本剤 1500 mg を 4 週間間隔で投与した。また、第 16 週目にトレメリムマブ 75 mg を 1 回投与
した。
*3:3 週間を 1 サイクルとして、①パクリタキセル(アルブミン懸濁型)
(第 1、8、15 日目に 100 mg/m2
を投与)+カルボプラチン(第 1 日目に AUC 5 又は 6 を投与)
、②ゲムシタビン(第 1、8 日目に
1,000 mg/m2 又は 1,250 mg/m2 を投与)+シスプラチン(第 1 日目に 75 mg/m2 を投与)若しくはカ
ルボプラチン(第 1 日目に AUC 5 又は 6 を投与)
(扁平上皮癌のみ)
、又は③ペメトレキセド(第
1 日目に 500 mg/m2 を投与)+シスプラチン(第 1 日目に 75 mg/m2 を投与)若しくはカルボプラ
チン(第 1 日目に AUC 5 又は 6 を投与)
(非扁平上皮癌のみ)のいずれかを 4 サイクル投与した。
対照群では、必要と判断された場合さらに 2 サイクルまで追加可とした。③ペメトレキセド+白
金製剤投与後に病勢が進行していない患者は、ペメトレキセド(500 mg/m2)維持療法(本剤併用
群では 4 週間間隔投与、対照群では 3 週間又は 4 週間間隔投与)に移行した。
図 6 OS の Kaplan-Meier 曲線
8