よむ、つかう、まなぶ。
10参考資料1 新型コロナワクチンに関する資料 (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00027.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第52回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
⑤
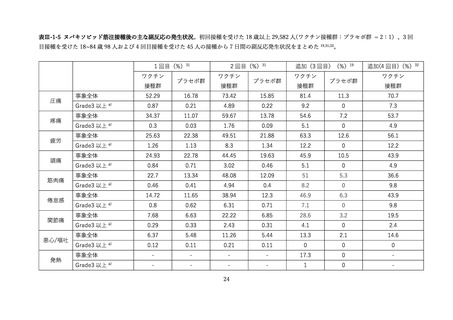
接種後7日間に報告された局所副反応
上記の表 VI-1 における文献②参照。
67
上記の表 VI-1 における文献③参照。
66
同時接種群:86.0% [77.6-92.1]
モデルナ群:91.3% [84.2-96.0]
インフルエンザ群:61.8% [50.9-71.9]
接種後7日間に報告された全身副反応
同時接種群:80.0% [70.8-87.3]
モデルナ群:83.7% [75.1-90.2]
インフルエンザ群:49.4% [38.7-60.2]
接種後 21 日間に報告された有害事象
同時接種群:17.0% [10.2-25.8]
モデルナ群:14.4% [8.3-22.7]
インフルエンザ群:10.9% [5.3-19.1]
重篤な有害事象、特に注目すべき有害事象、死亡は報告されなかった。
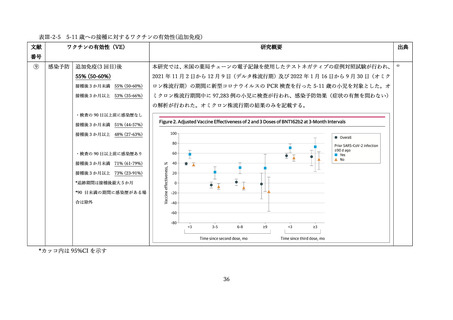
⑥
接種後7日以内の副反応
同時接種群:局所 70.1%、全身 60.1%
ノババックス群: 局所 57.6%、全身 45.7%
インフルエンザ群:局所 39.4%、全身 47.2%
プラセボ群:局所 17.9%、全身 36.3%
接種後 21 日以内の有害事象
同時接種群:18.4%(重篤な有害事象 0.5%)
ノババックス群: 17.6%(重篤な有害事象 0.6%)
インフルエンザ群:14.5%(重篤な有害事象 0%)
プラセボ群:14.0%(重篤な有害事象 0.6%)
75
接種後7日間に報告された局所副反応
上記の表 VI-1 における文献②参照。
67
上記の表 VI-1 における文献③参照。
66
同時接種群:86.0% [77.6-92.1]
モデルナ群:91.3% [84.2-96.0]
インフルエンザ群:61.8% [50.9-71.9]
接種後7日間に報告された全身副反応
同時接種群:80.0% [70.8-87.3]
モデルナ群:83.7% [75.1-90.2]
インフルエンザ群:49.4% [38.7-60.2]
接種後 21 日間に報告された有害事象
同時接種群:17.0% [10.2-25.8]
モデルナ群:14.4% [8.3-22.7]
インフルエンザ群:10.9% [5.3-19.1]
重篤な有害事象、特に注目すべき有害事象、死亡は報告されなかった。
⑥
接種後7日以内の副反応
同時接種群:局所 70.1%、全身 60.1%
ノババックス群: 局所 57.6%、全身 45.7%
インフルエンザ群:局所 39.4%、全身 47.2%
プラセボ群:局所 17.9%、全身 36.3%
接種後 21 日以内の有害事象
同時接種群:18.4%(重篤な有害事象 0.5%)
ノババックス群: 17.6%(重篤な有害事象 0.6%)
インフルエンザ群:14.5%(重篤な有害事象 0%)
プラセボ群:14.0%(重篤な有害事象 0.6%)
75