よむ、つかう、まなぶ。
資料2-8_堀田参考人提出資 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33521.html |
| 出典情報 | 今後のがん研究のあり方に関する有識者会議(第11回 6/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
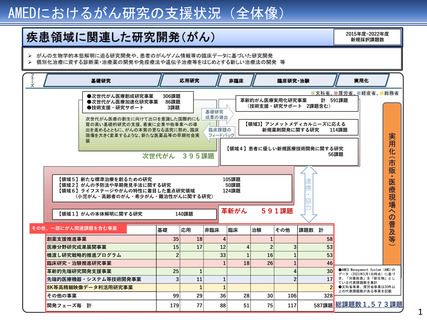
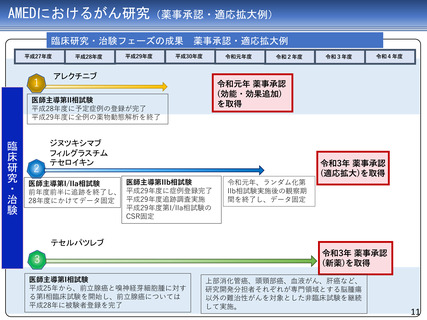
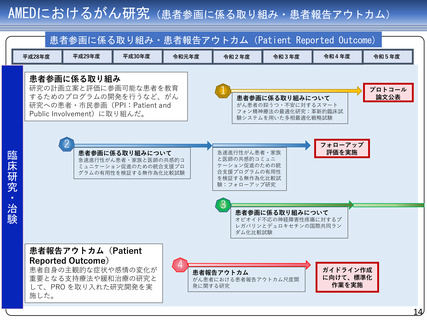
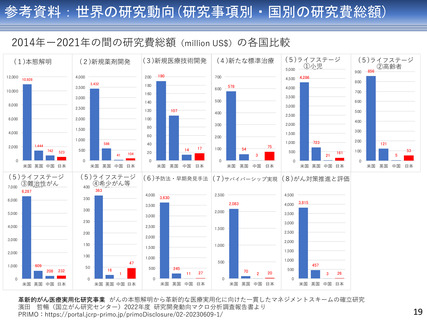
AMEDにおけるがん研究(薬事承認・適応拡大例)
臨床研究・治験フェーズの成果
平成27年度
1
平成28年度
平成29年度
薬事承認・適応拡大例
平成30年度
令和元年度
アレクチニブ
2
令和3年度
令和4年度
令和元年 薬事承認
(効能・効果追加)
を取得
医師主導第II相試験
平成28年度に予定症例の登録が完了
平成29年度に全例の薬物動態解析を終了
臨
床
研
究
・
治
験
令和2年度
ジヌツキシマブ
フィルグラスチム
テセロイキン
令和3年 薬事承認
(適応拡大)を取得
医師主導第IIb相試験
医師主導第I/IIa相試験
前年度前半に追跡を終了し、 平成29年度に症例登録完了
平成29年度追跡調査実施
28年度にかけてデータ固定
平成29年度第I/IIa相試験の
CSR固定
令和元年、ランダム化第
IIb相試験実施後の観察期
間を終了し、データ固定
テセルパツレブ
3
医師主導第I相試験
平成25年から、前立腺癌と嗅神経芽細胞腫に対す
る第I相臨床試験を開始し、前立腺癌については
平成28年に被験者登録を完了
令和3年 薬事承認
(新薬)を取得
上部消化管癌、頭頸部癌、血液がん、肝癌など、
研究開発分担者それぞれが専門領域とする脳腫瘍
以外の難治性がんを対象とした非臨床試験を継続
して実施。
11
臨床研究・治験フェーズの成果
平成27年度
1
平成28年度
平成29年度
薬事承認・適応拡大例
平成30年度
令和元年度
アレクチニブ
2
令和3年度
令和4年度
令和元年 薬事承認
(効能・効果追加)
を取得
医師主導第II相試験
平成28年度に予定症例の登録が完了
平成29年度に全例の薬物動態解析を終了
臨
床
研
究
・
治
験
令和2年度
ジヌツキシマブ
フィルグラスチム
テセロイキン
令和3年 薬事承認
(適応拡大)を取得
医師主導第IIb相試験
医師主導第I/IIa相試験
前年度前半に追跡を終了し、 平成29年度に症例登録完了
平成29年度追跡調査実施
28年度にかけてデータ固定
平成29年度第I/IIa相試験の
CSR固定
令和元年、ランダム化第
IIb相試験実施後の観察期
間を終了し、データ固定
テセルパツレブ
3
医師主導第I相試験
平成25年から、前立腺癌と嗅神経芽細胞腫に対す
る第I相臨床試験を開始し、前立腺癌については
平成28年に被験者登録を完了
令和3年 薬事承認
(新薬)を取得
上部消化管癌、頭頸部癌、血液がん、肝癌など、
研究開発分担者それぞれが専門領域とする脳腫瘍
以外の難治性がんを対象とした非臨床試験を継続
して実施。
11
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。
有料会員登録のお問い合わせはこちらから。