よむ、つかう、まなぶ。
薬-2○関係業界からの意見聴取について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
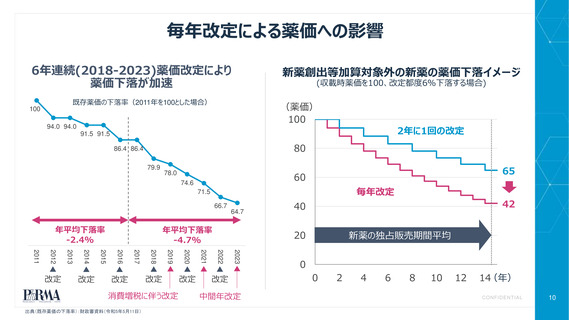
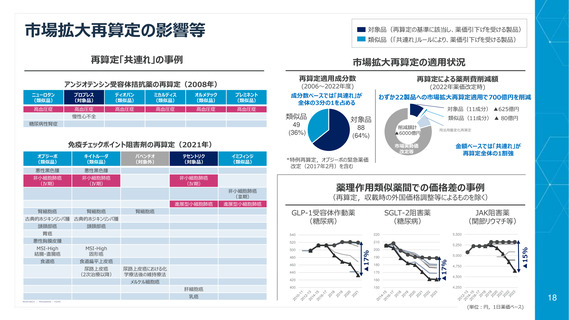
ドラッグラグ再燃の兆し
好ましくない政策変更の結果、世界的に販売される新薬が日本で上市されるスピードが低下している
世界的に販売される新薬のうち、日本において利用可能な新薬
の過去5年間の割合(日米比較)
日本
49%
53%
55%
米国
56%
57%
国内未上市
18%
18%
17%
16%
16%
82%
82%
83%
84%
84%
2016
2017
2018
2019
2020
8 パーセント低下
51%
47%
45%
44%
43%
2017
2018
2019
2020
国内上市
2016
15
出典:2021年6月時点におけるIQVIAアナリティクスリンク、米国食品医薬品局(FDA)、欧州医薬品庁(EMA)、日本医薬品医療機器総合機構(PMDA)のデータをPhRMAが分析
注:2011年1月1日から2020年12月31日の間にFDA,EMAおよび/もしくはPMDAが承認しいずれかの国で上市された新規医薬品成分
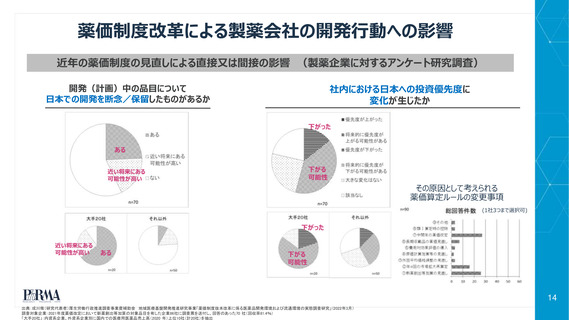
好ましくない政策変更の結果、世界的に販売される新薬が日本で上市されるスピードが低下している
世界的に販売される新薬のうち、日本において利用可能な新薬
の過去5年間の割合(日米比較)
日本
49%
53%
55%
米国
56%
57%
国内未上市
18%
18%
17%
16%
16%
82%
82%
83%
84%
84%
2016
2017
2018
2019
2020
8 パーセント低下
51%
47%
45%
44%
43%
2017
2018
2019
2020
国内上市
2016
15
出典:2021年6月時点におけるIQVIAアナリティクスリンク、米国食品医薬品局(FDA)、欧州医薬品庁(EMA)、日本医薬品医療機器総合機構(PMDA)のデータをPhRMAが分析
注:2011年1月1日から2020年12月31日の間にFDA,EMAおよび/もしくはPMDAが承認しいずれかの国で上市された新規医薬品成分