よむ、つかう、まなぶ。
薬-2○関係業界からの意見聴取について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
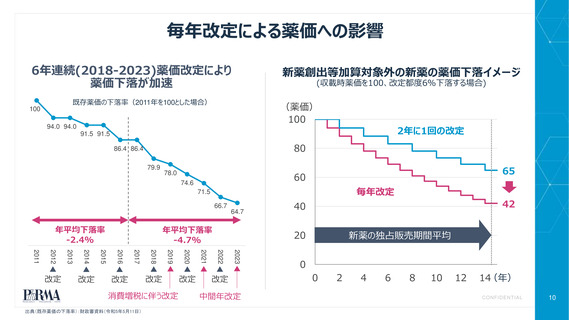
薬価改定時の追加効能等に対する価値評価
真の臨床的有用性の検証に係る加算
(評価対象のデータ・エビデンス範囲の拡大)
新薬創出等加算適用品に対する改定時加算の適用
意見
•
真の臨床的有用性加算についても、前述の新薬収載時
の有用性系加算の提案同様に、評価の対象となるデー
タ・エビデンスの範囲を拡充し、薬価上適切に評価される
ようにすべき
意見
•
新薬創出等加算適用品が改定時加算の適用を受ける場
合には、新薬創出等加算を適用した後に改定時加算の
上乗せを行う等、加算の適用順を変更して、改定前薬価
を上回る薬価評価が実現するようにすべき
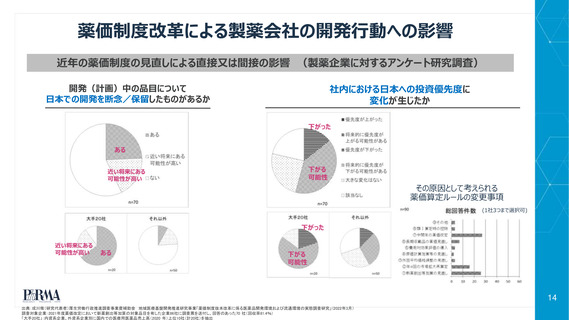
希少疾病加算
(抗悪性腫瘍剤の効能追加時に適用されないケースの解消)
複数の改定時加算の併算定
意見
•
抗悪性腫瘍剤が希少疾病に該当する悪性腫瘍の効能
追加を行った場合、市販後の希少疾病加算の適用検討
に当たっては、既存効能と追加効能の非類似性,追加
効能の開発リスク等を個別製品毎に十分に検討し、加算
の適否が判断されるようにすべき
意見
•
現行ルールにおいて、市販後の加算は原則併算定すること
ができないことになっているが、異なる効能がそれぞれ異な
る改定時加算の対象となる場合には、加算の併算定が
認められるようにすべき
23
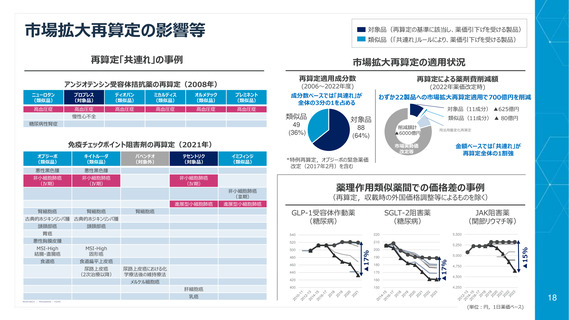
真の臨床的有用性の検証に係る加算
(評価対象のデータ・エビデンス範囲の拡大)
新薬創出等加算適用品に対する改定時加算の適用
意見
•
真の臨床的有用性加算についても、前述の新薬収載時
の有用性系加算の提案同様に、評価の対象となるデー
タ・エビデンスの範囲を拡充し、薬価上適切に評価される
ようにすべき
意見
•
新薬創出等加算適用品が改定時加算の適用を受ける場
合には、新薬創出等加算を適用した後に改定時加算の
上乗せを行う等、加算の適用順を変更して、改定前薬価
を上回る薬価評価が実現するようにすべき
希少疾病加算
(抗悪性腫瘍剤の効能追加時に適用されないケースの解消)
複数の改定時加算の併算定
意見
•
抗悪性腫瘍剤が希少疾病に該当する悪性腫瘍の効能
追加を行った場合、市販後の希少疾病加算の適用検討
に当たっては、既存効能と追加効能の非類似性,追加
効能の開発リスク等を個別製品毎に十分に検討し、加算
の適否が判断されるようにすべき
意見
•
現行ルールにおいて、市販後の加算は原則併算定すること
ができないことになっているが、異なる効能がそれぞれ異な
る改定時加算の対象となる場合には、加算の併算定が
認められるようにすべき
23