よむ、つかう、まなぶ。
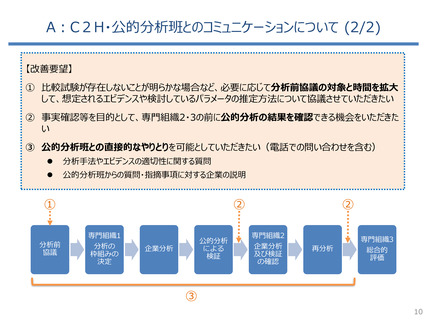
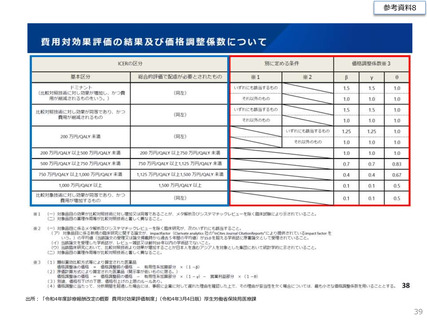
費ー1参考3-2○制度見直しに関する検討(その2)について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000182080_00016.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第65回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
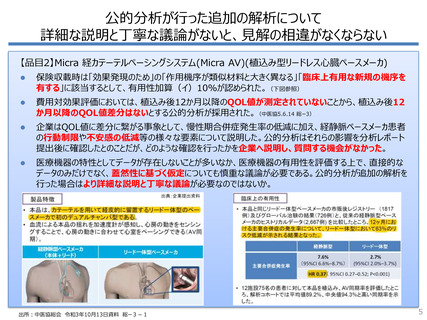
医療機器の特性と費用対効果評価への影響
医薬品
市場規模
• 約9兆円
• 高額品目数:
500億円以上13品目
• 製品数:約16,000製品
特定保険医療材料
費用対効果評価への影響
• 約1兆円
• 高額区分数:
• 製品ごとに試験を実施する余力
50億円以上約30区分
が小さい
• 製品数:1200機能区分約20万製品
• 銘柄別方式
• 機能区分別方式
(個別品目ごとに償還価格を
(同様の機能を有する類似製品群に
価格算定ルール
設定)
同一の償還価格を設定)
→革新性を評価しやすい一方、
→価格競争が誘発され、
価格競争は起こりにくい
製品の置き換わりが起こりやすい
• 短期間に製品が置き換わるため、
比較研究を行いにくい
• 多種多様な要素技術からなる
工業製品
• 臨床使用時に「モノの効果」+
「使用者の技量」
• 決まった開発プロセス・評価方法がない
• RCTによる優越性などに限らず、
個別にリスクアセスメントが行われ
る(参考資料1)
• 改良・改善が中心
(軽量化、操作性向上等)
• 比較試験を必ずしも要しない
• 主に医師等が使用
• 医師の技術に影響を受ける
• 海外と使用方法が異なる場合が
ある
開発プロセス
• 基本的に薬理作用を有する
科学物質
• 評価方法が基本的に確立
イノベーションの
• 新規機序が中心
⽅向性
使用⽅法
• 患者自身が服用、
または医療機関での投薬
(参考資料2)
出所:「令和2 年度 厚生労働省医政局経済課 委託事業医療機器・体外診断用医薬品 の保険適用に関するガイドブック」および「薬事政策」PMDA方眞美,
2018年10月」を基に一部改変
7
医薬品
市場規模
• 約9兆円
• 高額品目数:
500億円以上13品目
• 製品数:約16,000製品
特定保険医療材料
費用対効果評価への影響
• 約1兆円
• 高額区分数:
• 製品ごとに試験を実施する余力
50億円以上約30区分
が小さい
• 製品数:1200機能区分約20万製品
• 銘柄別方式
• 機能区分別方式
(個別品目ごとに償還価格を
(同様の機能を有する類似製品群に
価格算定ルール
設定)
同一の償還価格を設定)
→革新性を評価しやすい一方、
→価格競争が誘発され、
価格競争は起こりにくい
製品の置き換わりが起こりやすい
• 短期間に製品が置き換わるため、
比較研究を行いにくい
• 多種多様な要素技術からなる
工業製品
• 臨床使用時に「モノの効果」+
「使用者の技量」
• 決まった開発プロセス・評価方法がない
• RCTによる優越性などに限らず、
個別にリスクアセスメントが行われ
る(参考資料1)
• 改良・改善が中心
(軽量化、操作性向上等)
• 比較試験を必ずしも要しない
• 主に医師等が使用
• 医師の技術に影響を受ける
• 海外と使用方法が異なる場合が
ある
開発プロセス
• 基本的に薬理作用を有する
科学物質
• 評価方法が基本的に確立
イノベーションの
• 新規機序が中心
⽅向性
使用⽅法
• 患者自身が服用、
または医療機関での投薬
(参考資料2)
出所:「令和2 年度 厚生労働省医政局経済課 委託事業医療機器・体外診断用医薬品 の保険適用に関するガイドブック」および「薬事政策」PMDA方眞美,
2018年10月」を基に一部改変
7