よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-4 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
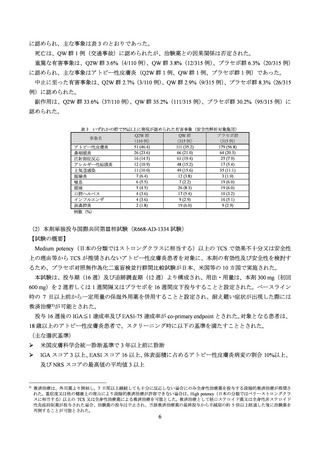
投与 52 週まで9)の本剤投与例における有害事象は、85.5%(53/62 例)に認められ、主な事象は表 11 の
とおりであった。
死亡及び投与中止に至った有害事象は認められなかった。
重篤な有害事象は、3.2%(2/62 例、末端回腸炎、注意欠如・多動性障害)に認められ、いずれも治験薬
との因果関係は否定された。
副作用は、25.8%(16/62 例)に認められた。
表 11 2 例以上に認められた有害事象(投与 52 週まで、安全性解析対象集団)
本剤投与例
本剤投与例
事象名
事象名
(62 例)
(62 例)
上咽頭炎
帯状疱疹
22 (35.5)
2 (3.2)
発熱
12 (19.4)
口腔ヘルペス
2 (3.2)
副鼻腔炎
COVID-19
10 (16.1)
2 (3.2)
2 (3.2)
アレルギー性結膜炎
10 (16.1)
胃腸炎
2 (3.2)
齲歯
5 (8.1)
麦粒腫
2 (3.2)
便秘
膿痂疹
3 (4.8)
2 (3.2)
皮膚乳頭腫
3 (4.8)
伝染性軟属腫
2 (3.2)
ざ瘡
好中球減少症
3 (4.8)
2 (3.2)
蕁麻疹
頭痛
3 (4.8)
2 (3.2)
関節痛
3 (4.8)
失神
3 (4.8)
2 (3.2)
足骨折
接触皮膚炎
3 (4.8)
手骨折
四肢痛
2 (3.2)
3 (4.8)
靱帯捻挫
処置後発熱
2 (3.2)
例数(%)
9)
二重盲検投与期に本剤群であった被験者は投与開始から投与 52 週まで、二重盲検投与期にプラセボ群であり非盲検延長投与期で本剤
が投与された被験者は投与 16 週以降投与 52 週までに認められた有害事象等が集計された。
11
とおりであった。
死亡及び投与中止に至った有害事象は認められなかった。
重篤な有害事象は、3.2%(2/62 例、末端回腸炎、注意欠如・多動性障害)に認められ、いずれも治験薬
との因果関係は否定された。
副作用は、25.8%(16/62 例)に認められた。
表 11 2 例以上に認められた有害事象(投与 52 週まで、安全性解析対象集団)
本剤投与例
本剤投与例
事象名
事象名
(62 例)
(62 例)
上咽頭炎
帯状疱疹
22 (35.5)
2 (3.2)
発熱
12 (19.4)
口腔ヘルペス
2 (3.2)
副鼻腔炎
COVID-19
10 (16.1)
2 (3.2)
2 (3.2)
アレルギー性結膜炎
10 (16.1)
胃腸炎
2 (3.2)
齲歯
5 (8.1)
麦粒腫
2 (3.2)
便秘
膿痂疹
3 (4.8)
2 (3.2)
皮膚乳頭腫
3 (4.8)
伝染性軟属腫
2 (3.2)
ざ瘡
好中球減少症
3 (4.8)
2 (3.2)
蕁麻疹
頭痛
3 (4.8)
2 (3.2)
関節痛
3 (4.8)
失神
3 (4.8)
2 (3.2)
足骨折
接触皮膚炎
3 (4.8)
手骨折
四肢痛
2 (3.2)
3 (4.8)
靱帯捻挫
処置後発熱
2 (3.2)
例数(%)
9)
二重盲検投与期に本剤群であった被験者は投与開始から投与 52 週まで、二重盲検投与期にプラセボ群であり非盲検延長投与期で本剤
が投与された被験者は投与 16 週以降投与 52 週までに認められた有害事象等が集計された。
11