よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-4 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
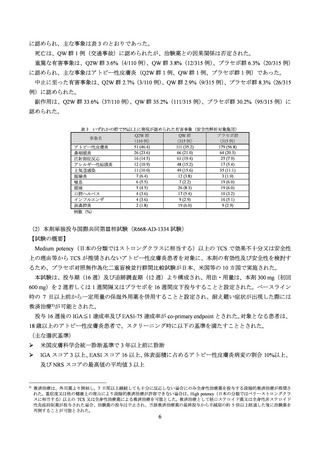
表 2 主な有効性評価項目の推移(FAS、NRI)
評価時期
Q2W 群
QW 群
12.9 (29/224)
12.1 (27/223)
4週
24.1 (54/224)
23.3 (52/223)
8週
IGA≦1 達成率
37.9 (85/224)
37.2 (83/223)
16 週
27.2 (61/224)
28.7 (64/223)
4週
45.1 (101/224)
48.0 (107/223)
8週
EASI-75 達成率
51.3 (115/224)
52.5 (117/223)
16 週
10.7 (24/224)
9.0 (20/223)
4週
20.5 (46/224)
27.8 (62/223)
8週
EASI-90 達成率a)
35.7 (80/224)
33.2 (74/223)
16 週
16.0 (34/213)
23.4 (47/201)
4週
そう痒 NRS スコア改善を
33.3
(71/213)
33.8 (68/201)
8
週
認めた被験者の割合b)
40.8 (87/213)
40.3 (81/201)
16 週
評価項目
プラセボ群
2.7 (6/224)
3.1 (7/224)
10.3 (23/224)
6.3 (14/224)
10.7 (24/224)
14.7 (33/224)
2.7 (6/224)
4.0 (9/224)
7.6 (17/224)
6.1 (13/212)
8.5 (18/212)
12.3 (26/212)
%(例数)
中止例又は救済治療例はNon-responder とした。
a) EASI スコアがベースラインから90%以上改善した被験者の割合
b) そう痒NRS スコアの日内最高値の週平均がベースラインから4 点以上低下した被験者の割合
(安全性)
有害事象は、Q2W 群 74.7%(171/229 例)、QW 群 69.3%(151/218 例)
、プラセボ群 66.7%(148/222 例)
に認められ、主な事象は表 6 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、Q2W 群 3.1%(7/229 例)
、QW 群 0.9%(2/218 例)、プラセボ群 5.4%(12/222 例)
に認められ、主な事象はアトピー性皮膚炎(Q2W 群 2 例、プラセボ群 3 例)であった。
中止に至った有害事象は、Q2W 群 1.7%(4/229 例)
、QW 群 1.8%(4/218 例)
、プラセボ群 0.9%(2/222
例)に認められた。
副作用は、Q2W 群 29.3%(67/229 例)
、QW 群 31.2%(68/218 例)
、プラセボ群 18.9%(42/222 例)に認め
られた。
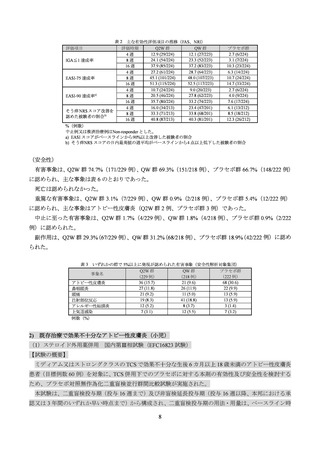
表 3 いずれかの群で 5%以上に発現が認められた有害事象(安全性解析対象集団)
Q2W 群
QW 群
プラセボ群
事象名
(222 例)
(229 例)
(218 例)
36 (15.7)
21 (9.6)
68 (30.6)
アトピー性皮膚炎
27 (11.8)
26 (11.9)
22 (9.9)
鼻咽頭炎
21 (9.2)
11 (5.0)
13 (5.9)
頭痛
19 (8.3)
41 (18.8)
13 (5.9)
注射部位反応
12 (5.2)
8 (3.7)
3 (1.4)
アレルギー性結膜炎
7 (3.1)
12 (5.5)
7 (3.2)
上気道感染
例数(%)
2) 既存治療で効果不十分なアトピー性皮膚炎(小児)
(1)ステロイド外用薬併用 国内第Ⅲ相試験(EFC16823 試験)
【試験の概要】
ミディアム又はストロングクラスの TCS で効果不十分な生後 6 カ月以上 18 歳未満のアトピー性皮膚炎
患者(目標例数 60 例)を対象に、TCS 併用下でのプラセボに対する本剤の有効性及び安全性を検討する
ため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
本試験は、二重盲検投与期(投与 16 週まで)及び非盲検延長投与期(投与 16 週以降、本邦における承
認又は 3 年間のいずれか早い時点まで)から構成され、二重盲検投与期の用法・用量は、ベースライン時
8
評価時期
Q2W 群
QW 群
12.9 (29/224)
12.1 (27/223)
4週
24.1 (54/224)
23.3 (52/223)
8週
IGA≦1 達成率
37.9 (85/224)
37.2 (83/223)
16 週
27.2 (61/224)
28.7 (64/223)
4週
45.1 (101/224)
48.0 (107/223)
8週
EASI-75 達成率
51.3 (115/224)
52.5 (117/223)
16 週
10.7 (24/224)
9.0 (20/223)
4週
20.5 (46/224)
27.8 (62/223)
8週
EASI-90 達成率a)
35.7 (80/224)
33.2 (74/223)
16 週
16.0 (34/213)
23.4 (47/201)
4週
そう痒 NRS スコア改善を
33.3
(71/213)
33.8 (68/201)
8
週
認めた被験者の割合b)
40.8 (87/213)
40.3 (81/201)
16 週
評価項目
プラセボ群
2.7 (6/224)
3.1 (7/224)
10.3 (23/224)
6.3 (14/224)
10.7 (24/224)
14.7 (33/224)
2.7 (6/224)
4.0 (9/224)
7.6 (17/224)
6.1 (13/212)
8.5 (18/212)
12.3 (26/212)
%(例数)
中止例又は救済治療例はNon-responder とした。
a) EASI スコアがベースラインから90%以上改善した被験者の割合
b) そう痒NRS スコアの日内最高値の週平均がベースラインから4 点以上低下した被験者の割合
(安全性)
有害事象は、Q2W 群 74.7%(171/229 例)、QW 群 69.3%(151/218 例)
、プラセボ群 66.7%(148/222 例)
に認められ、主な事象は表 6 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、Q2W 群 3.1%(7/229 例)
、QW 群 0.9%(2/218 例)、プラセボ群 5.4%(12/222 例)
に認められ、主な事象はアトピー性皮膚炎(Q2W 群 2 例、プラセボ群 3 例)であった。
中止に至った有害事象は、Q2W 群 1.7%(4/229 例)
、QW 群 1.8%(4/218 例)
、プラセボ群 0.9%(2/222
例)に認められた。
副作用は、Q2W 群 29.3%(67/229 例)
、QW 群 31.2%(68/218 例)
、プラセボ群 18.9%(42/222 例)に認め
られた。
表 3 いずれかの群で 5%以上に発現が認められた有害事象(安全性解析対象集団)
Q2W 群
QW 群
プラセボ群
事象名
(222 例)
(229 例)
(218 例)
36 (15.7)
21 (9.6)
68 (30.6)
アトピー性皮膚炎
27 (11.8)
26 (11.9)
22 (9.9)
鼻咽頭炎
21 (9.2)
11 (5.0)
13 (5.9)
頭痛
19 (8.3)
41 (18.8)
13 (5.9)
注射部位反応
12 (5.2)
8 (3.7)
3 (1.4)
アレルギー性結膜炎
7 (3.1)
12 (5.5)
7 (3.2)
上気道感染
例数(%)
2) 既存治療で効果不十分なアトピー性皮膚炎(小児)
(1)ステロイド外用薬併用 国内第Ⅲ相試験(EFC16823 試験)
【試験の概要】
ミディアム又はストロングクラスの TCS で効果不十分な生後 6 カ月以上 18 歳未満のアトピー性皮膚炎
患者(目標例数 60 例)を対象に、TCS 併用下でのプラセボに対する本剤の有効性及び安全性を検討する
ため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
本試験は、二重盲検投与期(投与 16 週まで)及び非盲検延長投与期(投与 16 週以降、本邦における承
認又は 3 年間のいずれか早い時点まで)から構成され、二重盲検投与期の用法・用量は、ベースライン時
8