よむ、つかう、まなぶ。
【資料1】検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方について (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
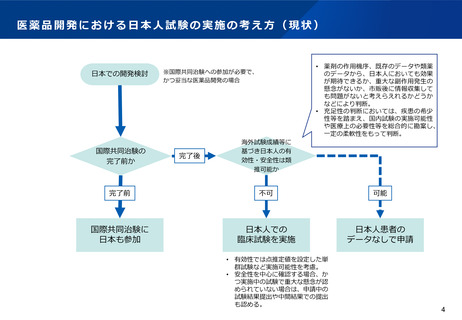
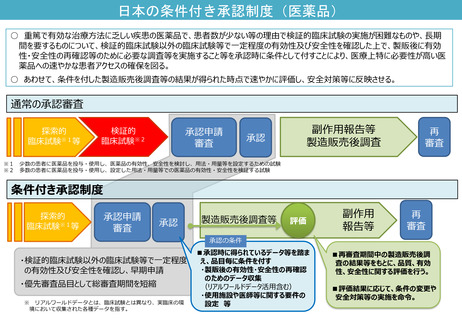
日本の条件付き承認制度(医薬品)
○ 重篤で有効な治療方法に乏しい疾患の医薬品で、患者数が少ない等の理由で検証的臨床試験の実施が困難なものや、長期
間を要するものについて、検証的臨床試験以外の臨床試験等で一定程度の有効性及び安全性を確認した上で、製販後に有効
性・安全性の再確認等のために必要な調査等を実施すること等を承認時に条件として付すことにより、医療上特に必要性が高い医
薬品への速やかな患者アクセスの確保を図る。
○ あわせて、条件を付した製造販売後調査等の結果が得られた時点で速やかに評価し、安全対策等に反映させる。
通常の承認審査
探索的
臨床試験※1等
※1
※2
検証的
臨床試験※2
承認申請
審査
副作用報告等
製造販売後調査
承認
再
審査
少数の患者に医薬品を投与・使用し、医薬品の有効性、安全性を検討し、用法・用量等を設定するための試験
多数の患者に医薬品を投与・使用し、設定した用法・用量等での医薬品の有効性・安全性を検証する試験
条件付き承認制度
探索的
臨床試験※1等
承認申請
審査
承認
製造販売後調査等
評価
副作用
報告等
再
審査
承認の条件
・検証的臨床試験以外の臨床試験等で一定程度
の有効性及び安全性を確認し、早期申請
・優先審査品目として総審査期間を短縮
※ リアルワールドデータとは、臨床試験とは異なり、実臨床の環
境において収集された各種データを指す。
■承認時に得られているデータ等を踏ま
え、品目毎に条件を付す
・製販後の有効性・安全性の再確認
のためのデータ収集
(リアルワールドデータ活用含む)
・使用施設や医師等に関する要件の
設定 等
■再審査期間中の製造販売後調
査の結果等をもとに、品質、有効
性、安全性に関する評価を行う。
■評価結果に応じて、条件の変更や
安全対策等の実施を命令。
○ 重篤で有効な治療方法に乏しい疾患の医薬品で、患者数が少ない等の理由で検証的臨床試験の実施が困難なものや、長期
間を要するものについて、検証的臨床試験以外の臨床試験等で一定程度の有効性及び安全性を確認した上で、製販後に有効
性・安全性の再確認等のために必要な調査等を実施すること等を承認時に条件として付すことにより、医療上特に必要性が高い医
薬品への速やかな患者アクセスの確保を図る。
○ あわせて、条件を付した製造販売後調査等の結果が得られた時点で速やかに評価し、安全対策等に反映させる。
通常の承認審査
探索的
臨床試験※1等
※1
※2
検証的
臨床試験※2
承認申請
審査
副作用報告等
製造販売後調査
承認
再
審査
少数の患者に医薬品を投与・使用し、医薬品の有効性、安全性を検討し、用法・用量等を設定するための試験
多数の患者に医薬品を投与・使用し、設定した用法・用量等での医薬品の有効性・安全性を検証する試験
条件付き承認制度
探索的
臨床試験※1等
承認申請
審査
承認
製造販売後調査等
評価
副作用
報告等
再
審査
承認の条件
・検証的臨床試験以外の臨床試験等で一定程度
の有効性及び安全性を確認し、早期申請
・優先審査品目として総審査期間を短縮
※ リアルワールドデータとは、臨床試験とは異なり、実臨床の環
境において収集された各種データを指す。
■承認時に得られているデータ等を踏ま
え、品目毎に条件を付す
・製販後の有効性・安全性の再確認
のためのデータ収集
(リアルワールドデータ活用含む)
・使用施設や医師等に関する要件の
設定 等
■再審査期間中の製造販売後調
査の結果等をもとに、品質、有効
性、安全性に関する評価を行う。
■評価結果に応じて、条件の変更や
安全対策等の実施を命令。