よむ、つかう、まなぶ。
【資料1】検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
今後の対応について(論点)
⚫
⚫
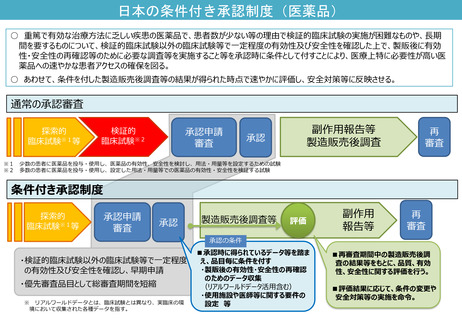
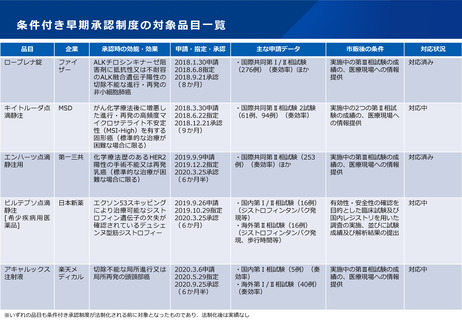
日本の条件付き承認制度の適用件数が少ない現状に鑑み、条件付き承認制度の対象のあり方について、どう考えるか。
•
米国迅速承認を受けた品目のうち、日本で承認を受けている品目は170件あり、そのうち米国のConvert(本承認)以前に承認を受けてい
るものは120件あるなど、実態としては日本でも多くの例で迅速承認相当の段階で通常の承認が行われているところ、日本の制度の在り
方についてどう考えるか。
•
米国の制度に対しては、効果の証明が不十分であること、それにもかかわらず企業のビジネスに利用されていること、検証的試験の実施
が遅延していることなどを批判する記事もある。FDAも抗がん剤への迅速承認の適用についてドラフトガイダンスを2023年3月に示し、
シングルアーム試験よりランダム化比較試験の実施を推奨するなど、運用の見直し行われていることを踏まえ、日本の制度のあり方につ
いてどう考えるか。
•
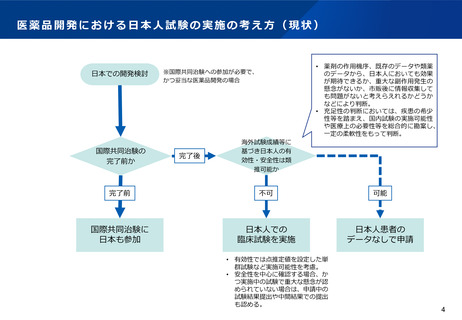
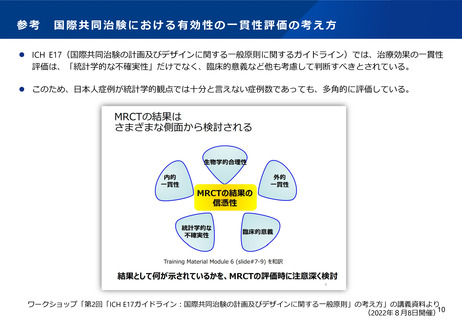
日本においては、本資料の前半の論点にあるように、日本人のデータが必要であることによる承認時期の遅れが生じるケースがある。こ
うした場合にも条件付き承認を適用していくことについて、どう考えるか。また、市販後には必ずしも臨床試験ではなく、製造販売後調
査によりデータを収集していくことについて、どう考えるか。
•
こうした点を踏まえ、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件の運用のあり方について、どう考えるか。日本
人の追加データの必要性のほか、不可逆的な進行性の疾患の進行抑制に寄与する可能性がある場合など、疾患や医薬品の特性に応じた取
扱いについてどう考えるか。
承認後に検証試験を実施することのフィージビリティについて、どう考えるか。
•
⚫
米国では、審査中に検証的試験を開始し、承認までに組み入れが一定程度進んでいる状況とすることや、治療ラインの異なる患者を対象
として実施するといった方法により、対応しているときいている。こうした運用が日本でも実現可能かについて、どう考えるか。
また、市販後に実施した検証的試験等の結果によっては、承認を取り消す可能性があることについて、その運用のあり方をどう
考えるか。
17
⚫
⚫
日本の条件付き承認制度の適用件数が少ない現状に鑑み、条件付き承認制度の対象のあり方について、どう考えるか。
•
米国迅速承認を受けた品目のうち、日本で承認を受けている品目は170件あり、そのうち米国のConvert(本承認)以前に承認を受けてい
るものは120件あるなど、実態としては日本でも多くの例で迅速承認相当の段階で通常の承認が行われているところ、日本の制度の在り
方についてどう考えるか。
•
米国の制度に対しては、効果の証明が不十分であること、それにもかかわらず企業のビジネスに利用されていること、検証的試験の実施
が遅延していることなどを批判する記事もある。FDAも抗がん剤への迅速承認の適用についてドラフトガイダンスを2023年3月に示し、
シングルアーム試験よりランダム化比較試験の実施を推奨するなど、運用の見直し行われていることを踏まえ、日本の制度のあり方につ
いてどう考えるか。
•
日本においては、本資料の前半の論点にあるように、日本人のデータが必要であることによる承認時期の遅れが生じるケースがある。こ
うした場合にも条件付き承認を適用していくことについて、どう考えるか。また、市販後には必ずしも臨床試験ではなく、製造販売後調
査によりデータを収集していくことについて、どう考えるか。
•
こうした点を踏まえ、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件の運用のあり方について、どう考えるか。日本
人の追加データの必要性のほか、不可逆的な進行性の疾患の進行抑制に寄与する可能性がある場合など、疾患や医薬品の特性に応じた取
扱いについてどう考えるか。
承認後に検証試験を実施することのフィージビリティについて、どう考えるか。
•
⚫
米国では、審査中に検証的試験を開始し、承認までに組み入れが一定程度進んでいる状況とすることや、治療ラインの異なる患者を対象
として実施するといった方法により、対応しているときいている。こうした運用が日本でも実現可能かについて、どう考えるか。
また、市販後に実施した検証的試験等の結果によっては、承認を取り消す可能性があることについて、その運用のあり方をどう
考えるか。
17