よむ、つかう、まなぶ。
【資料1】検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
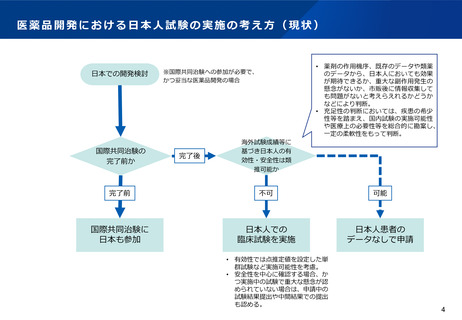
医薬品開発における日本人試験の実施の考え方(現状)
日本での開発検討
国際共同治験の
完了前か
• 薬剤の作用機序、既存のデータや類薬
のデータから、日本人においても効果
が期待できるか、重大な副作用発生の
懸念がないか、市販後に情報収集して
も問題がないと考えらえれるかどうか
などにより判断。
• 充足性の判断においては、疾患の希少
性等を踏まえ、国内試験の実施可能性
や医療上の必要性等を総合的に勘案し、
一定の柔軟性をもって判断。
※国際共同治験への参加が必要で、
かつ妥当な医薬品開発の場合
完了後
海外試験成績等に
基づき日本人の有
効性・安全性は類
推可能か
完了前
不可
可能
国際共同治験に
日本も参加
日本人での
臨床試験を実施
日本人患者の
データなしで申請
• 有効性では点推定値を設定した単
群試験など実施可能性を考慮。
• 安全性を中心に確認する場合、か
つ実施中の試験で重大な懸念が認
められていない場合は、申請中の
試験結果提出や中間結果での提出
も認める。
4
日本での開発検討
国際共同治験の
完了前か
• 薬剤の作用機序、既存のデータや類薬
のデータから、日本人においても効果
が期待できるか、重大な副作用発生の
懸念がないか、市販後に情報収集して
も問題がないと考えらえれるかどうか
などにより判断。
• 充足性の判断においては、疾患の希少
性等を踏まえ、国内試験の実施可能性
や医療上の必要性等を総合的に勘案し、
一定の柔軟性をもって判断。
※国際共同治験への参加が必要で、
かつ妥当な医薬品開発の場合
完了後
海外試験成績等に
基づき日本人の有
効性・安全性は類
推可能か
完了前
不可
可能
国際共同治験に
日本も参加
日本人での
臨床試験を実施
日本人患者の
データなしで申請
• 有効性では点推定値を設定した単
群試験など実施可能性を考慮。
• 安全性を中心に確認する場合、か
つ実施中の試験で重大な懸念が認
められていない場合は、申請中の
試験結果提出や中間結果での提出
も認める。
4