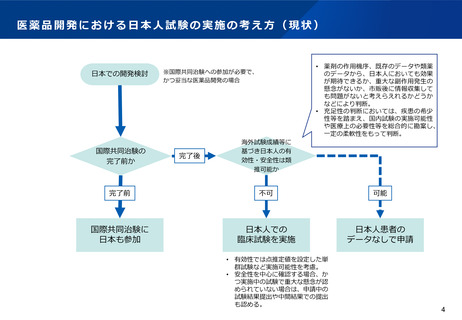
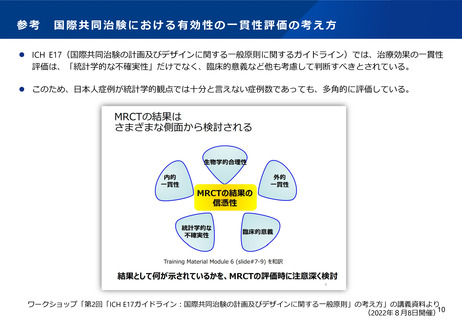
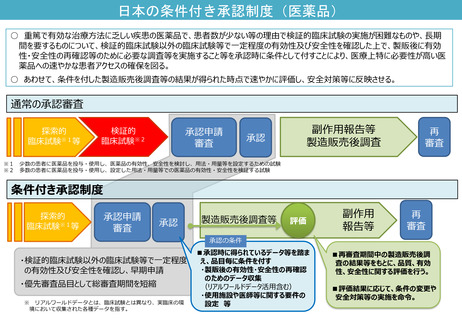
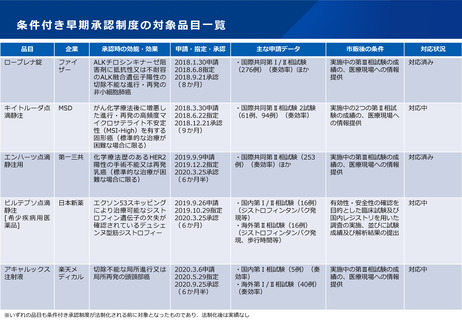
よむ、つかう、まなぶ。
【資料1】検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
米国迅速承認制度に対する批判記事(ブルームバーグ)
効果の確証ない新薬、迅速承認で製薬会社に多額の収入-米FDAに批判も
Robert Langreth、Fiona Rutherford、Immanual John Milton、Madeline Campbell
2023年5月18日 9:01 JST
•新薬をいち早く患者に届ける制度、効果の証明不十分との批判も
•大きな収入もたらすビジネスモデルに、後で承認撤回のリスクも
幼少期に発症し10代の頃には自力歩行が困難になる難病、デュシェンヌ型筋ジストロフィー(DMD)の治療薬として「エクソンディ
ス51」が承認されたとき、それが実際に疾患の進行を遅らせるという証拠はなかった。それから7年後の現在も、製造元の米サレプタ・
セラピューティクスは決定的なデータを提示していない。
サレプタはこれまでにエクソンディス51(一般名エテプリルセン)と2つの関連薬剤から計25億ドル(約3400億円)余りを売り上げた。
この3つの医薬品はいずれも迅速承認と呼ばれる米制度を通じて承認された。この制度が提供する近道により、患者に治療法の選択肢がほ
とんどか全くない場合、製薬会社は最終的な試験の完了前に医薬品を販売することができる。
エクソンディスのケースでは、サレプタの検証的試験が始まったのは承認から4年後で、完了は販売開始から8年後の2024年以降とな
る予定だ。
これは珍しいことではない。ブルームバーグ・ニュースが米食品医薬品局(FDA)のデータベースを分析したところでは、迅速承認さ
れたものの本承認に向けた検証的試験が「遅延」となお記載されている医薬品は4月時点で19品目。これには試験が正式な期限を過ぎて
いる場合と予定より遅れている場合が含まれる。またこの分析で、企業が何らかのデータをFDAに提出していたため、試験が予定より遅
れていても遅延に分類されなかった迅速承認の医薬品も7品目見つかった。
(中略)
新薬をいち早く患者に届けるための迅速承認制度は、やや不明瞭な方法として始まったが、今ではこれをビジネスモデルとする企業もい
る。この制度を通じて既に販売されている医薬品について、FDAが最終的なデータを企業に提出させるための十分な措置を講じていない
との批判もある。
(後略)
引用元:https://www.bloomberg.co.jp/news/articles/2023-05-18/RUOD17T0AFB401
16
効果の確証ない新薬、迅速承認で製薬会社に多額の収入-米FDAに批判も
Robert Langreth、Fiona Rutherford、Immanual John Milton、Madeline Campbell
2023年5月18日 9:01 JST
•新薬をいち早く患者に届ける制度、効果の証明不十分との批判も
•大きな収入もたらすビジネスモデルに、後で承認撤回のリスクも
幼少期に発症し10代の頃には自力歩行が困難になる難病、デュシェンヌ型筋ジストロフィー(DMD)の治療薬として「エクソンディ
ス51」が承認されたとき、それが実際に疾患の進行を遅らせるという証拠はなかった。それから7年後の現在も、製造元の米サレプタ・
セラピューティクスは決定的なデータを提示していない。
サレプタはこれまでにエクソンディス51(一般名エテプリルセン)と2つの関連薬剤から計25億ドル(約3400億円)余りを売り上げた。
この3つの医薬品はいずれも迅速承認と呼ばれる米制度を通じて承認された。この制度が提供する近道により、患者に治療法の選択肢がほ
とんどか全くない場合、製薬会社は最終的な試験の完了前に医薬品を販売することができる。
エクソンディスのケースでは、サレプタの検証的試験が始まったのは承認から4年後で、完了は販売開始から8年後の2024年以降とな
る予定だ。
これは珍しいことではない。ブルームバーグ・ニュースが米食品医薬品局(FDA)のデータベースを分析したところでは、迅速承認さ
れたものの本承認に向けた検証的試験が「遅延」となお記載されている医薬品は4月時点で19品目。これには試験が正式な期限を過ぎて
いる場合と予定より遅れている場合が含まれる。またこの分析で、企業が何らかのデータをFDAに提出していたため、試験が予定より遅
れていても遅延に分類されなかった迅速承認の医薬品も7品目見つかった。
(中略)
新薬をいち早く患者に届けるための迅速承認制度は、やや不明瞭な方法として始まったが、今ではこれをビジネスモデルとする企業もい
る。この制度を通じて既に販売されている医薬品について、FDAが最終的なデータを企業に提出させるための十分な措置を講じていない
との批判もある。
(後略)
引用元:https://www.bloomberg.co.jp/news/articles/2023-05-18/RUOD17T0AFB401
16