よむ、つかう、まなぶ。
【資料2】セラミック製の歯科用インプラント材に係る評価指標作成事業の成果に基づき策定された医療機器の評価指標について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37966.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第7回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5.20. 令和 3 年 5 月 31 日付け薬生機審発 0531 第 5 号「歯科用医療機器の生物学的安全性評価の基本的考え方の
一部改正について」
5.21. 令和 4 年 11 月 2 日付け薬生発 1102 第 10 号「歯科用インプラント承認基準の改正について」
6.
評価に対して留意すべき事項
開発するセラミック製歯科用インプラント(以下「本品」という。
)に対する評価を明確にするため、次
の(1)から(6)の事項を考慮すること。
(1) 基本的事項
1)開発の経緯
本品を設計、開発した経緯について、本品の独自性、改良点、既存品との同等性の観点から、必要
な事項について明確にすること。
2)臨床的位置づけ
本品の臨床的位置づけについて、下記の点等から必要な事項について明確にすること。
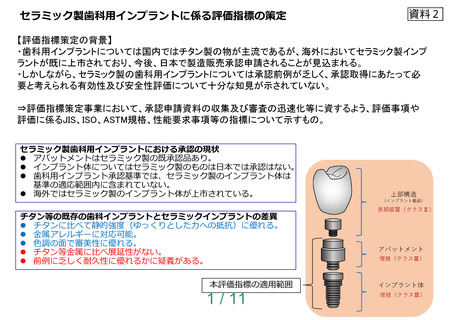
・既存のチタン製歯科用インプラントと同等のものか。
・既存のチタン製歯科用インプラントに対して、即時負荷や早期負荷等の優位性を意図するものか。
・その他アンメットメディカルニーズに対応するものか。
なお、材料固有の発色による審美性は機能回復の観点における必須事項ではないと考えることから
本評価指標においては対象としないが、色調に係る審美性の標榜を意図する場合は、臨床的意義と意
図する色調を明らかにし、別途評価が必要となりうること。また、金属アレルギーに対して低リスク
であることの標榜を意図する場合は、原材料に金属材料が含まれていないこと、あるいは既に得られ
ている知見等から評価が必要であること。
3)使用方法
以下の事項等について、本品の特性に応じた使用方法を確立し、十分な安全性を確保すること。
・歯科用インプラントフィクスチャについて、埋入窩の形成方法及び埋入方法等本品の埋入に係る留
意事項。
・歯科用インプラントアバットメントを歯科用インプラントフィクスチャに締結する際、及び歯科イ
ンプラント用上部構造材を歯科用インプラントアバットメントに締結する際の締結方法及び推奨トル
ク。
・歯科用インプラントフィクスチャの抜去が必要となった際の留意事項。特に既存のチタン製歯科用
インプラントとは異なる懸念事項。
4)併用医療機器
併用医療機器について、以下の点等を記載すること。
・歯科インプラント用上部構造材を接続して使用する場合は、販売名及び認証番号等により当該機器
を特定すること。
・歯科用インプラントフィクスチャの埋植や歯科用インプラントアバットメントの締結等に専用の器
具を使用する場合は、販売名、一般的名称及び認証・届出番号等により当該器具を特定すること。な
お、併用する器具を専用品として特定しない場合は、併用医療機器として求められる条件(適合規格、
該当する一般的名称等)を規定することで差し支えない。
(2) 品質、性能及び安全性に関する評価に関して
品質、性能及び安全性を確保するために必要と考えられる評価項目は以下の通りであり、平成 30 年
6 月 12 日付け薬生機審発 0612 第 4 号「歯科用医療機器の製造販売承認申請等に必要な生物学的安全性
6 / 11
一部改正について」
5.21. 令和 4 年 11 月 2 日付け薬生発 1102 第 10 号「歯科用インプラント承認基準の改正について」
6.
評価に対して留意すべき事項
開発するセラミック製歯科用インプラント(以下「本品」という。
)に対する評価を明確にするため、次
の(1)から(6)の事項を考慮すること。
(1) 基本的事項
1)開発の経緯
本品を設計、開発した経緯について、本品の独自性、改良点、既存品との同等性の観点から、必要
な事項について明確にすること。
2)臨床的位置づけ
本品の臨床的位置づけについて、下記の点等から必要な事項について明確にすること。
・既存のチタン製歯科用インプラントと同等のものか。
・既存のチタン製歯科用インプラントに対して、即時負荷や早期負荷等の優位性を意図するものか。
・その他アンメットメディカルニーズに対応するものか。
なお、材料固有の発色による審美性は機能回復の観点における必須事項ではないと考えることから
本評価指標においては対象としないが、色調に係る審美性の標榜を意図する場合は、臨床的意義と意
図する色調を明らかにし、別途評価が必要となりうること。また、金属アレルギーに対して低リスク
であることの標榜を意図する場合は、原材料に金属材料が含まれていないこと、あるいは既に得られ
ている知見等から評価が必要であること。
3)使用方法
以下の事項等について、本品の特性に応じた使用方法を確立し、十分な安全性を確保すること。
・歯科用インプラントフィクスチャについて、埋入窩の形成方法及び埋入方法等本品の埋入に係る留
意事項。
・歯科用インプラントアバットメントを歯科用インプラントフィクスチャに締結する際、及び歯科イ
ンプラント用上部構造材を歯科用インプラントアバットメントに締結する際の締結方法及び推奨トル
ク。
・歯科用インプラントフィクスチャの抜去が必要となった際の留意事項。特に既存のチタン製歯科用
インプラントとは異なる懸念事項。
4)併用医療機器
併用医療機器について、以下の点等を記載すること。
・歯科インプラント用上部構造材を接続して使用する場合は、販売名及び認証番号等により当該機器
を特定すること。
・歯科用インプラントフィクスチャの埋植や歯科用インプラントアバットメントの締結等に専用の器
具を使用する場合は、販売名、一般的名称及び認証・届出番号等により当該器具を特定すること。な
お、併用する器具を専用品として特定しない場合は、併用医療機器として求められる条件(適合規格、
該当する一般的名称等)を規定することで差し支えない。
(2) 品質、性能及び安全性に関する評価に関して
品質、性能及び安全性を確保するために必要と考えられる評価項目は以下の通りであり、平成 30 年
6 月 12 日付け薬生機審発 0612 第 4 号「歯科用医療機器の製造販売承認申請等に必要な生物学的安全性
6 / 11