よむ、つかう、まなぶ。
【資料2】セラミック製の歯科用インプラント材に係る評価指標作成事業の成果に基づき策定された医療機器の評価指標について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37966.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第7回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
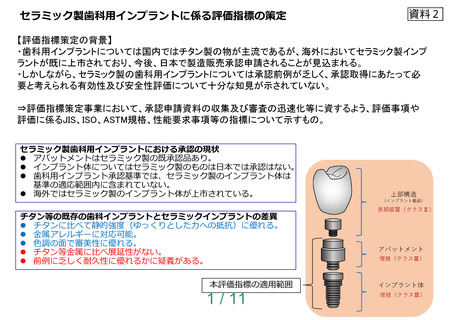
リスク分析及びリスク評価は、歯科用インプラントフィクスチャ又は歯科用インプラントアバ
ットメントにおける表面処理による残留物及び歯科用インプラントの疲労強度に関する点も含め
て JIS T 14971 又は ISO 14971 によって実施すること。
サ
包装
a) 一次包装(直接の容器)
一次包装は、微生物の侵入を防止することができ、通常の取扱い、輸送、保管中に製品を適切
に保護できるものであること。
b) 二次包装(外装)
二次包装は、通常の取扱い、輸送、保管中に製品及び一次包装を適切に保護できるものである
こと。
2)安全性に関する事項
生物学的安全性について、JIS T 0993-1 又は ISO 10993-1、JIS T 6001 又は ISO 7405、令和 3 年 5
月 31 日付け薬生機審発 0531 第 5 号「歯科用医療機器の生物学的安全性評価の基本的考え方の一部改
正について」の別添 1 「歯科用医療機器の生物学的安全性評価の基本的考え方」に基づいて評価を行
い、安全性を示すこと。なお、当該通知において歯科用インプラントは接触部位が「体内植込」、接
触時間が「長期的(永久)
」とされており、原則、当該分類に基づく評価が必要となる。その際には、
製品の使用方法等も十分考慮すること。なお、充填液を介して包装材料が歯科インプラントと直接又
は間接的に接触する場合はその評価についても行う必要がある。
MR 安全性について、令和元年 8 月 1 日付け薬生機審発 0801 第 1 号/薬生安発 0801 第 4 号「植込み
型医療機器等の MR 安全性にかかる対応について」に基づいて対応を行うこと。
3)性能に関する事項
ア
物理的要求事項
1. 表面粗さ
表面処理された歯科用インプラントにあっては、令和 4 年 11 月 2 日付け薬生発 1102 第 10
号「歯科用インプラント承認基準の改正について」の別紙:測定条件等により表面粗さ[算
術平均粗さ(Ra)及び最大高さ(Rz)又は輪郭曲面の算術平均高さ(Sa)及び最大高さ(Sz)]を測
定すること。
2. 曲げ強さ
ISO 13356 に準じて試験したとき、歯科用インプラントアバットメントについては、500MPa
以上(2 軸曲げ)又は 800MPa 以上(4 点曲げ)であること、歯科用インプラントフィクスチャに
ついては、800MPa 以上(4 点曲げ)であること。
3. 疲労強度
リスク評価によって、疲労強度に関して破損リスクが最も高いと分析された歯科用インプ
ラントフィクスチャ、歯科用インプラントアバットメント、専用アバットメントスクリュ及
び歯科用インプラント用上部構造材の各最終製品を用いて、
規定のトルクで締結して組立て、
システム全体の強度評価のため JIS T 6005 又は ISO 14801 に準じて生理食塩水中で疲労試
験を実施したとき、組立構成品の疲労強度の値が既承認品と同等以上であること、もしくは
臨床上許容できる値であること。各最終製品が滅菌品又は用時加工・調整される製品につい
ては、滅菌後又は最もリスクが高いと想定される形状に加工・調整後のものを用いること。
特に、組立構成品の一部が他社既承認品である場合には、その組合せを、疲労試験による
リスク評価の対象として本試験を実施しなければならない。
8 / 11
ットメントにおける表面処理による残留物及び歯科用インプラントの疲労強度に関する点も含め
て JIS T 14971 又は ISO 14971 によって実施すること。
サ
包装
a) 一次包装(直接の容器)
一次包装は、微生物の侵入を防止することができ、通常の取扱い、輸送、保管中に製品を適切
に保護できるものであること。
b) 二次包装(外装)
二次包装は、通常の取扱い、輸送、保管中に製品及び一次包装を適切に保護できるものである
こと。
2)安全性に関する事項
生物学的安全性について、JIS T 0993-1 又は ISO 10993-1、JIS T 6001 又は ISO 7405、令和 3 年 5
月 31 日付け薬生機審発 0531 第 5 号「歯科用医療機器の生物学的安全性評価の基本的考え方の一部改
正について」の別添 1 「歯科用医療機器の生物学的安全性評価の基本的考え方」に基づいて評価を行
い、安全性を示すこと。なお、当該通知において歯科用インプラントは接触部位が「体内植込」、接
触時間が「長期的(永久)
」とされており、原則、当該分類に基づく評価が必要となる。その際には、
製品の使用方法等も十分考慮すること。なお、充填液を介して包装材料が歯科インプラントと直接又
は間接的に接触する場合はその評価についても行う必要がある。
MR 安全性について、令和元年 8 月 1 日付け薬生機審発 0801 第 1 号/薬生安発 0801 第 4 号「植込み
型医療機器等の MR 安全性にかかる対応について」に基づいて対応を行うこと。
3)性能に関する事項
ア
物理的要求事項
1. 表面粗さ
表面処理された歯科用インプラントにあっては、令和 4 年 11 月 2 日付け薬生発 1102 第 10
号「歯科用インプラント承認基準の改正について」の別紙:測定条件等により表面粗さ[算
術平均粗さ(Ra)及び最大高さ(Rz)又は輪郭曲面の算術平均高さ(Sa)及び最大高さ(Sz)]を測
定すること。
2. 曲げ強さ
ISO 13356 に準じて試験したとき、歯科用インプラントアバットメントについては、500MPa
以上(2 軸曲げ)又は 800MPa 以上(4 点曲げ)であること、歯科用インプラントフィクスチャに
ついては、800MPa 以上(4 点曲げ)であること。
3. 疲労強度
リスク評価によって、疲労強度に関して破損リスクが最も高いと分析された歯科用インプ
ラントフィクスチャ、歯科用インプラントアバットメント、専用アバットメントスクリュ及
び歯科用インプラント用上部構造材の各最終製品を用いて、
規定のトルクで締結して組立て、
システム全体の強度評価のため JIS T 6005 又は ISO 14801 に準じて生理食塩水中で疲労試
験を実施したとき、組立構成品の疲労強度の値が既承認品と同等以上であること、もしくは
臨床上許容できる値であること。各最終製品が滅菌品又は用時加工・調整される製品につい
ては、滅菌後又は最もリスクが高いと想定される形状に加工・調整後のものを用いること。
特に、組立構成品の一部が他社既承認品である場合には、その組合せを、疲労試験による
リスク評価の対象として本試験を実施しなければならない。
8 / 11