よむ、つかう、まなぶ。
【参考資料3】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(個別テーマ) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
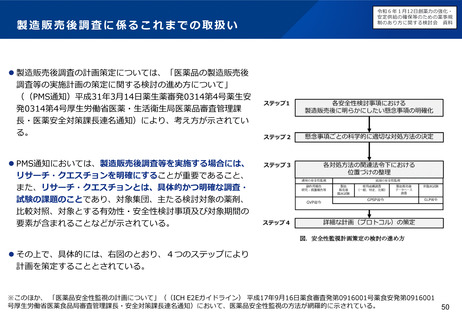
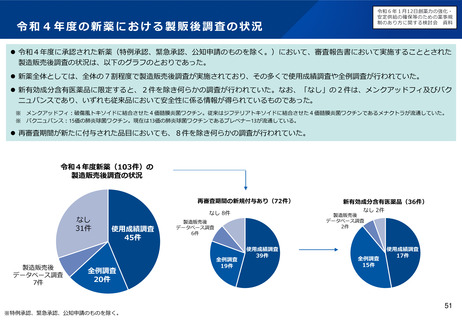
小児用医薬品の開発促進の必要性
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
注:ここでの小児は、新生児~15歳程度を想定(疾患によっては、低出生体重児等も含まれる場合が考えられる。)
▍小児用医薬品開発の課題
• 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が
小さいことや治験実施の困難さ(症例集積性、コスト)等の理由
から、一般的に開発が進みにくいことが指摘されている。
• 近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用の医薬品でのロスが課題と
なっている。
現状の取組について
特定用途医薬品指定制度
再審査期間の運用
• これまで、我が国では、特定用途医薬品指定制度の創設、再審査
期間の運用見直し等(※1)の対応を進めてきたが、更なる取組に
よる小児用医薬品の開発促進が求められている。
※1 小児に対応した治験環境の整備や薬価上の措置を含む。
▍検討の方向性
• 欧米では、その対策の一つとして、成人の医薬品開発時に小児用
医薬品の開発計画策定を義務づける等の取組を行っている。
• 欧米の制度を参考にしつつ、我が国の状況も踏まえながら(※2)、
小児用医薬品開発を成人用と同時に進めるための仕組みや、その
実効性を高めるための対応について、検討する必要があると考え
られる。
※2 厚生労働科学特別研究「小児がん及び小児希少難治性疾患に係る医薬品開発
の推進制度に資する調査研究」において、海外制度の調査や国内関係者へのア
ンケートを実施。
新たな小児用医薬品開発促進策
14
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
注:ここでの小児は、新生児~15歳程度を想定(疾患によっては、低出生体重児等も含まれる場合が考えられる。)
▍小児用医薬品開発の課題
• 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が
小さいことや治験実施の困難さ(症例集積性、コスト)等の理由
から、一般的に開発が進みにくいことが指摘されている。
• 近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用の医薬品でのロスが課題と
なっている。
現状の取組について
特定用途医薬品指定制度
再審査期間の運用
• これまで、我が国では、特定用途医薬品指定制度の創設、再審査
期間の運用見直し等(※1)の対応を進めてきたが、更なる取組に
よる小児用医薬品の開発促進が求められている。
※1 小児に対応した治験環境の整備や薬価上の措置を含む。
▍検討の方向性
• 欧米では、その対策の一つとして、成人の医薬品開発時に小児用
医薬品の開発計画策定を義務づける等の取組を行っている。
• 欧米の制度を参考にしつつ、我が国の状況も踏まえながら(※2)、
小児用医薬品開発を成人用と同時に進めるための仕組みや、その
実効性を高めるための対応について、検討する必要があると考え
られる。
※2 厚生労働科学特別研究「小児がん及び小児希少難治性疾患に係る医薬品開発
の推進制度に資する調査研究」において、海外制度の調査や国内関係者へのア
ンケートを実施。
新たな小児用医薬品開発促進策
14