よむ、つかう、まなぶ。
【参考資料3】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(個別テーマ) (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
対応の方向性(案)
令和6年3月21日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
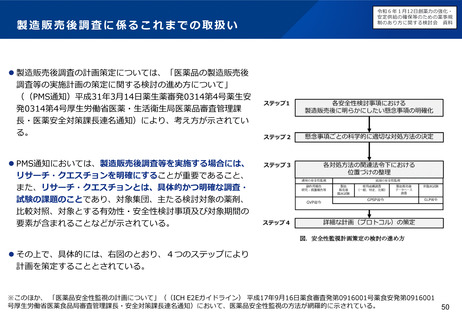
▍中央IRBの活用促進
⚫
原則として中央IRBによる審査が望ましい点を文書化する方向性を含め、中央IRBの活用の促進に向けた検討を進めてはどうか。
具体的には、医療関係者の意見も聴きつつ、厚生労働省・PMDA・製薬業界において検討を進めることとしてはどうか。
▍治験費用の算定方法の合理化
⚫
治験費用の算定方法について、業務量や市場価格に基づいた算定(欧米ではFair Market Valueと呼ばれ、広く浸透している概
念)の国内への導入の実現性を含め、医療機関・治験依頼者双方が納得感を得られる方法について必要な検討を進めることと
してはどうか。
▍治験運用の更なる合理化
⚫
例えば以下のような点について、医療機関を含む関係者の意見も聴きつつ、厚生労働省・PMDA・製薬業界において検討し、要
すればGCP省令の改正を含め、更なる合理化に向けた取り組みを進めてはどうか。併せてPMDAの体制強化を進めるものとする。
•
IRB審議事項の整理(通知・審議が必要な安全性情報の範囲の特定、医療機関追加の際の審議の要否、審査区分(迅速、簡
易、報告)の整理等)、IRB成立要件の検討
•
ICF様式の共通化とその普及
•
治験管理(治験計画・変更届出)の効率化
•
治験実施において厳格に実施する必要のあること、非効率となっていることの具体的事例の洗い出しと周知(モニタリング
の頻度、逸脱発生時の対応・管理の基本的な考え方の例示、電子化の推進等)
•
分散型治験等の新たな形態の治験に対応したGCPのあり方についての検討
60
令和6年3月21日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
▍中央IRBの活用促進
⚫
原則として中央IRBによる審査が望ましい点を文書化する方向性を含め、中央IRBの活用の促進に向けた検討を進めてはどうか。
具体的には、医療関係者の意見も聴きつつ、厚生労働省・PMDA・製薬業界において検討を進めることとしてはどうか。
▍治験費用の算定方法の合理化
⚫
治験費用の算定方法について、業務量や市場価格に基づいた算定(欧米ではFair Market Valueと呼ばれ、広く浸透している概
念)の国内への導入の実現性を含め、医療機関・治験依頼者双方が納得感を得られる方法について必要な検討を進めることと
してはどうか。
▍治験運用の更なる合理化
⚫
例えば以下のような点について、医療機関を含む関係者の意見も聴きつつ、厚生労働省・PMDA・製薬業界において検討し、要
すればGCP省令の改正を含め、更なる合理化に向けた取り組みを進めてはどうか。併せてPMDAの体制強化を進めるものとする。
•
IRB審議事項の整理(通知・審議が必要な安全性情報の範囲の特定、医療機関追加の際の審議の要否、審査区分(迅速、簡
易、報告)の整理等)、IRB成立要件の検討
•
ICF様式の共通化とその普及
•
治験管理(治験計画・変更届出)の効率化
•
治験実施において厳格に実施する必要のあること、非効率となっていることの具体的事例の洗い出しと周知(モニタリング
の頻度、逸脱発生時の対応・管理の基本的な考え方の例示、電子化の推進等)
•
分散型治験等の新たな形態の治験に対応したGCPのあり方についての検討
60