よむ、つかう、まなぶ。
【参考資料3】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(個別テーマ) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
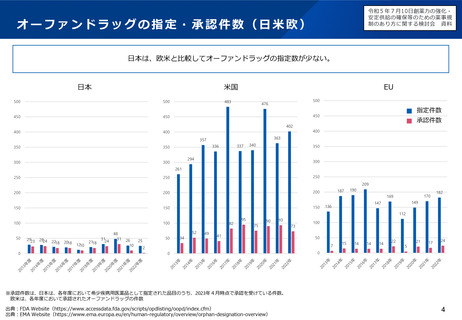
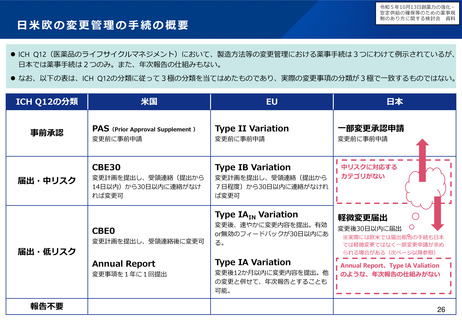
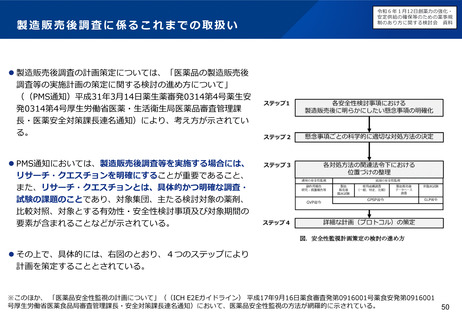
オーファン制度の日米欧比較
日本
米国
• 患者数50,000人未満又は指定
難病
• 医療上の必要性
• 開発の可能性
患者数200,000人未満又は米国に
おいて開発コストの回収が困難
優先審査
あり
ー
ー
手数料減免
あり
あり
あり
開発助成
医薬基盤・健康・栄養研究所に
よる助成事業
FDAによるOrphan Product Grant
Program
ECまたは他の団体による
税制優遇
あり
あり
ー
データ保護
再審査期間として10年
(通常8年)
7年(通常5年)
10年(通常8年)※
指定要件
優
遇
措
置
EU
• 有病率10,000人に5人以下
• 重篤又は慢性的衰弱
• 医療上の必要性
※通常の新薬が8年間のデータ保護+2年間の市場独占であるのに対し、オーファンは10年間のデータ
保護であるため、その間は後発医薬品の承認申請ができない。また、その対象は同種同効薬にも及ぶ。
5
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
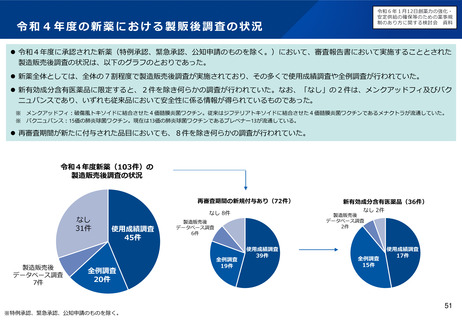
オーファン制度の日米欧比較
日本
米国
• 患者数50,000人未満又は指定
難病
• 医療上の必要性
• 開発の可能性
患者数200,000人未満又は米国に
おいて開発コストの回収が困難
優先審査
あり
ー
ー
手数料減免
あり
あり
あり
開発助成
医薬基盤・健康・栄養研究所に
よる助成事業
FDAによるOrphan Product Grant
Program
ECまたは他の団体による
税制優遇
あり
あり
ー
データ保護
再審査期間として10年
(通常8年)
7年(通常5年)
10年(通常8年)※
指定要件
優
遇
措
置
EU
• 有病率10,000人に5人以下
• 重篤又は慢性的衰弱
• 医療上の必要性
※通常の新薬が8年間のデータ保護+2年間の市場独占であるのに対し、オーファンは10年間のデータ
保護であるため、その間は後発医薬品の承認申請ができない。また、その対象は同種同効薬にも及ぶ。
5