よむ、つかう、まなぶ。
薬ー1参考2 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
*:参加予定の国際共同治験とは別に実施される日本人対象の第Ⅰ相試験であり、日本人に
おける被験薬の忍容性、PK の評価を主な目的とし、併せて実施済みの外国人対象の第Ⅰ相
試験の成績との比較(国内外の類似性検討)も目的とする。
加えて、実際の審査品目における日本人第Ⅰ相試験の実施状況や、日本人及び外国
人における薬物動態の差異に係る PMDA の評価の例、日本人第Ⅰ相試験において日本
人特有の安全性の懸念が見られた例などが示された。また、製薬業界のアンケート結
果に基づく、国際共同試験に参加するために自国・地域での P1 試験を実施した件数
(図6)が示された。
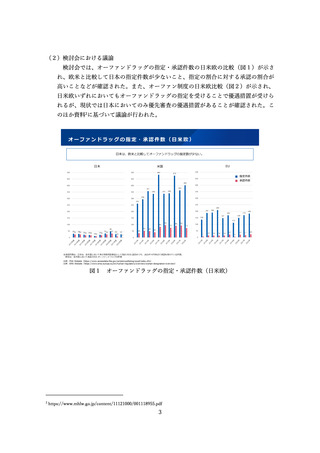
海外の規制状況(業界アンケート結果)
▍国際共同試験に参加するために自国・地域でのP1試験を実施した件数(FIH試験が健康成人対象のもの)
国際共同試験の件数
(自国・地域でFIH試験不参加)
MRCT前に自国・地域で
追加実施したP1試験数
国・地域を限定した
Safety run in設定数
US
30
2
0
EU
42
1
0
日本
60
62(1)
2
中国
30
24(4)
0
その他アジア
36
3
0
※括弧内の数字は規制当局から求められて実施した件数
(このうち、アジア地域でFIHが実施されたもの)
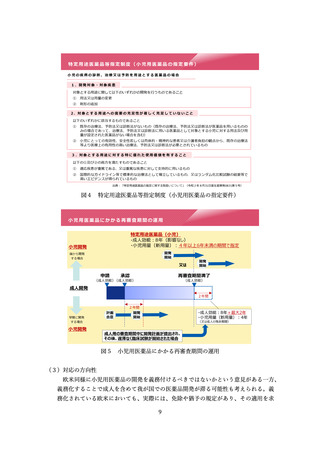
国際共同試験の件数
(自国・地域でFIH試験不参加)
MRCT前に自国・地域で
追加実施したP1試験数
国・地域を限定した
Safety run in設定数
US
7
1
0
EU
8
0
0
日本
5
7
0
中国
3
3
0
その他アジア
0
0
0
出典:製薬協・PhRMA・EFPIAが製薬企業38社に対して2023年6月8日~30日に行ったアンケート(対象:2021年以降に、初回申請のためにMRCTを実施した品目)結果より抜粋
18
図6 国際共同試験に参加するために自国・地域での P1 試験を実施した件数
(FIH 試験が健康成人対象のもの)
構成員からは、次のような意見があった。
⚫ 日本市場の魅力は外国と比較して低下しており、ドラッグ・ロスを解決す
るためには本件のみならず様々な課題に取り組む必要がある。
⚫ 日本で小規模な第Ⅰ相試験を実施することが、国際共同治験の被験者のリ
スク軽減にどの程度つながるのか、仮に日本人での第Ⅰ相試験を原則不要
とした場合、日本への新薬の導入が加速される、あるいは、日本で開発未
着手の新薬が減るのかは、両方とも不確かである点を認識した上で検討す
べき課題である。
⚫ 第Ⅰ相試験をスキップすることによる国際共同治験の被験者への安全性の
懸念と、第Ⅰ相試験を実施することでドラッグ・ロスが生じるという患者
13
おける被験薬の忍容性、PK の評価を主な目的とし、併せて実施済みの外国人対象の第Ⅰ相
試験の成績との比較(国内外の類似性検討)も目的とする。
加えて、実際の審査品目における日本人第Ⅰ相試験の実施状況や、日本人及び外国
人における薬物動態の差異に係る PMDA の評価の例、日本人第Ⅰ相試験において日本
人特有の安全性の懸念が見られた例などが示された。また、製薬業界のアンケート結
果に基づく、国際共同試験に参加するために自国・地域での P1 試験を実施した件数
(図6)が示された。
海外の規制状況(業界アンケート結果)
▍国際共同試験に参加するために自国・地域でのP1試験を実施した件数(FIH試験が健康成人対象のもの)
国際共同試験の件数
(自国・地域でFIH試験不参加)
MRCT前に自国・地域で
追加実施したP1試験数
国・地域を限定した
Safety run in設定数
US
30
2
0
EU
42
1
0
日本
60
62(1)
2
中国
30
24(4)
0
その他アジア
36
3
0
※括弧内の数字は規制当局から求められて実施した件数
(このうち、アジア地域でFIHが実施されたもの)
国際共同試験の件数
(自国・地域でFIH試験不参加)
MRCT前に自国・地域で
追加実施したP1試験数
国・地域を限定した
Safety run in設定数
US
7
1
0
EU
8
0
0
日本
5
7
0
中国
3
3
0
その他アジア
0
0
0
出典:製薬協・PhRMA・EFPIAが製薬企業38社に対して2023年6月8日~30日に行ったアンケート(対象:2021年以降に、初回申請のためにMRCTを実施した品目)結果より抜粋
18
図6 国際共同試験に参加するために自国・地域での P1 試験を実施した件数
(FIH 試験が健康成人対象のもの)
構成員からは、次のような意見があった。
⚫ 日本市場の魅力は外国と比較して低下しており、ドラッグ・ロスを解決す
るためには本件のみならず様々な課題に取り組む必要がある。
⚫ 日本で小規模な第Ⅰ相試験を実施することが、国際共同治験の被験者のリ
スク軽減にどの程度つながるのか、仮に日本人での第Ⅰ相試験を原則不要
とした場合、日本への新薬の導入が加速される、あるいは、日本で開発未
着手の新薬が減るのかは、両方とも不確かである点を認識した上で検討す
べき課題である。
⚫ 第Ⅰ相試験をスキップすることによる国際共同治験の被験者への安全性の
懸念と、第Ⅰ相試験を実施することでドラッグ・ロスが生じるという患者
13