よむ、つかう、まなぶ。
薬ー1参考2 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
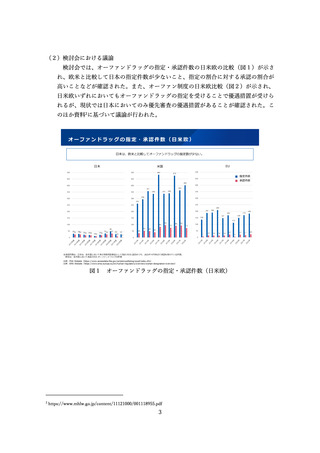
試験の計画が医薬品医療機器総合機構(以下「PMDA」という。)と合意している、
第Ⅲ相試験の結果が得られている、といった開発段階であることを求められる場合
があった。しかしながら、特にベンチャー企業では、希少疾病用医薬品に指定され
ていることをもって、投資を呼び込み、日本の臨床開発に着手可能となる場合があ
るため、臨床開発の後期にならなければ指定を受けられない場合、日本への開発を
断念する場合がある。
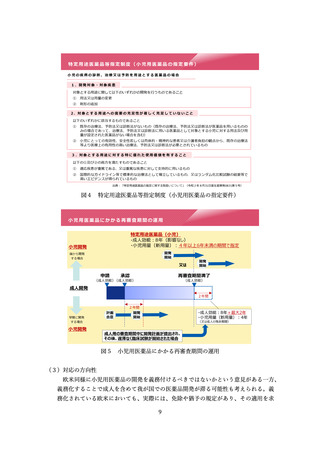
薬機法第 77 条の2の指定対象の要件においては、開発の可能性については必ずし
も明示されていないことも踏まえ、開発の可能性については、国内での開発を行う
ことのできる体制及び計画を有しているかどうかを確認することとされた。具体的
には、承認申請に至るまでに実施する予定の臨床試験(プロトコールは不要であり、
試験計画の概観が把握できればよい)を示すとともに、少なくとも第Ⅰ相試験を実
施するために必要な非臨床試験については概ね完了している程度の段階であれば、
要件を満たすとされた。
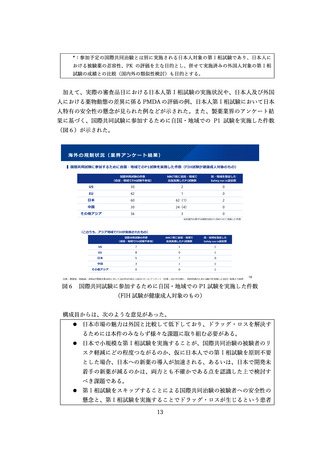
指定の早期化に伴い、開発の進捗に伴い指定要件を満たさなくなった場合には、
指定取り消しとなる取扱を明確化することとされた。具体的には、次のような場合
であって、指定要件を満たさなくなると考えられる場合に、事前に指定を受けた者
の意見を聴取した上で、取り消しを行うことが想定される。
・臨床的位置付けが同様で、代替薬となり得る医薬品が承認された場合
・臨床試験で達成基準を満たさなかった場合
・安全性を根拠に指定された場合であって、開発の進展に伴い指定の根拠とした
安全性上の優位性を確保できなくなった場合
④
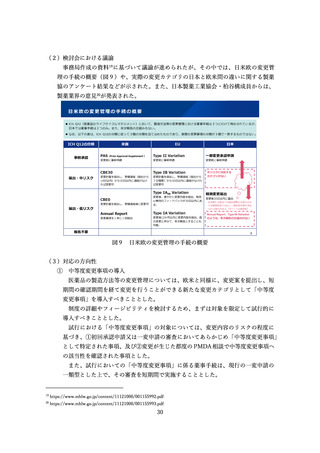
オーファン指定要件の見直しに伴う優遇措置等の取扱いについて
PMDA の審査期間の目標値は、優先審査で9か月、通常審査で 12 か月であると
ころ、令和3年度の実績はそれぞれ 8.5 か月、11.7 か月であるが、リソースに余裕
はなく、優先審査品目の増加に対応するためにはさらなる体制強化が必須である。
このため、PMDA の体制強化を並行して検討することとし、それが実現するまでの
間は優先審査の対象品目については、従来の優先審査の要件を満たすものの範囲と
することとされた。
新医薬品の承認は、薬事・食品衛生審議会(現薬事審議会)における審議後、事
務手続を経て厚生労働大臣が承認することにより行われている。新規医薬品につい
ては、年8回(1,2,4,5,7,8,10,11 月)程度審議会を開催しているが、承認は年4回
(3,6,9,12 月)のみ行っているため、審議会から承認まで2か月程度の期間を要す
る場合がある。この点について、いずれの品目についても、審議会開催後、速やか
に承認することとし、審議会から承認までの期間の短縮を図ることとされた。これ
により、PMDA の実質的審査に充てられる時間を確保し、希少疾病用医薬品の優先
審査にも対応しやすくなることが期待される。
6
第Ⅲ相試験の結果が得られている、といった開発段階であることを求められる場合
があった。しかしながら、特にベンチャー企業では、希少疾病用医薬品に指定され
ていることをもって、投資を呼び込み、日本の臨床開発に着手可能となる場合があ
るため、臨床開発の後期にならなければ指定を受けられない場合、日本への開発を
断念する場合がある。
薬機法第 77 条の2の指定対象の要件においては、開発の可能性については必ずし
も明示されていないことも踏まえ、開発の可能性については、国内での開発を行う
ことのできる体制及び計画を有しているかどうかを確認することとされた。具体的
には、承認申請に至るまでに実施する予定の臨床試験(プロトコールは不要であり、
試験計画の概観が把握できればよい)を示すとともに、少なくとも第Ⅰ相試験を実
施するために必要な非臨床試験については概ね完了している程度の段階であれば、
要件を満たすとされた。
指定の早期化に伴い、開発の進捗に伴い指定要件を満たさなくなった場合には、
指定取り消しとなる取扱を明確化することとされた。具体的には、次のような場合
であって、指定要件を満たさなくなると考えられる場合に、事前に指定を受けた者
の意見を聴取した上で、取り消しを行うことが想定される。
・臨床的位置付けが同様で、代替薬となり得る医薬品が承認された場合
・臨床試験で達成基準を満たさなかった場合
・安全性を根拠に指定された場合であって、開発の進展に伴い指定の根拠とした
安全性上の優位性を確保できなくなった場合
④
オーファン指定要件の見直しに伴う優遇措置等の取扱いについて
PMDA の審査期間の目標値は、優先審査で9か月、通常審査で 12 か月であると
ころ、令和3年度の実績はそれぞれ 8.5 か月、11.7 か月であるが、リソースに余裕
はなく、優先審査品目の増加に対応するためにはさらなる体制強化が必須である。
このため、PMDA の体制強化を並行して検討することとし、それが実現するまでの
間は優先審査の対象品目については、従来の優先審査の要件を満たすものの範囲と
することとされた。
新医薬品の承認は、薬事・食品衛生審議会(現薬事審議会)における審議後、事
務手続を経て厚生労働大臣が承認することにより行われている。新規医薬品につい
ては、年8回(1,2,4,5,7,8,10,11 月)程度審議会を開催しているが、承認は年4回
(3,6,9,12 月)のみ行っているため、審議会から承認まで2か月程度の期間を要す
る場合がある。この点について、いずれの品目についても、審議会開催後、速やか
に承認することとし、審議会から承認までの期間の短縮を図ることとされた。これ
により、PMDA の実質的審査に充てられる時間を確保し、希少疾病用医薬品の優先
審査にも対応しやすくなることが期待される。
6