よむ、つかう、まなぶ。
薬ー1参考2 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
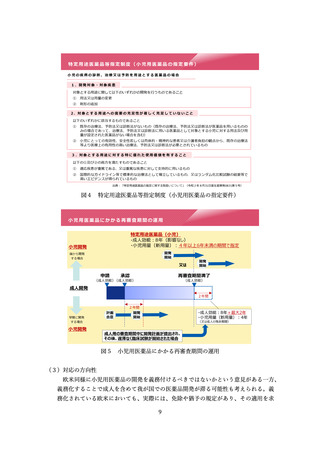
これらの調査については、
再審査のために本来必要のない使用成績調査が課されているのではないか
使用成績調査について、海外では日本ほど多く活用されておらず、製薬企業や
医療機関にとっての負担が大きいのではないか
全例調査について、医療機関にとっての負担が大きい一方で、有効性や安全性
に係る迅速な情報の収集に資するものになっていないのではないか
製造販売後データベース調査の利用を促進すべきではないか
等の課題を指摘されている。
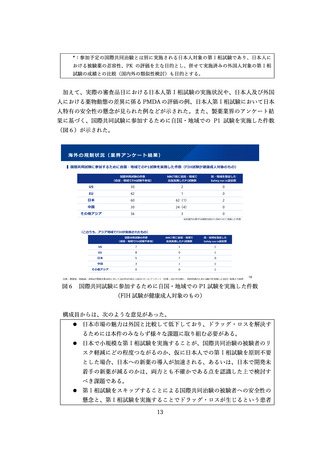
このため、使用成績調査を含めた製造販売後の追加の安全性管理のあり方を検討し、
それぞれの医薬品の特徴に根ざした合理的な調査計画の策定が可能となる方策につい
て検討した。
(2)検討会における議論
新薬の製造販売後調査の状況(図8)や、最近承認された品目における製造販売後
調査の実施理由、製薬業界から提出された欧米との本邦での追加の安全性監視計画の
比較等などを含めた事務局資料17に基づいて議論が進められた。また、日本製薬工業
協会・柏谷構成員からは、製薬業界の意見18が発表された。
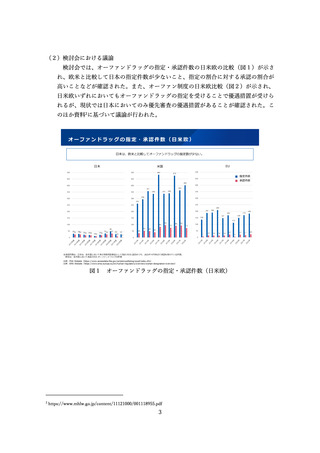
令和4年度の新薬における製販後調査の状況
⚫ 令和4年度に承認された新薬(特例承認、緊急承認、公知申請のものを除く。)において、審査報告書において実施することとされた
製造販売後調査の状況は、以下のグラフのとおりであった。
⚫ 新薬全体としては、全体の7割程度で製造販売後調査が実施されており、その多くで使用成績調査や全例調査が行われていた。
⚫ 新有効成分含有医薬品に限定すると、2件を除き何らかの調査が行われていた。なお、「なし」の2件は、メンクアッドフィ及びバク
ニュバンスであり、いずれも従来品において安全性に係る情報が得られているものであった。
※ メンクアッドフィ:破傷風トキソイドに結合させた4価髄膜炎菌ワクチン。従来はジフテリアトキソイドに結合させた4価髄膜炎菌ワクチンであるメナクトラが流通していた。
※ バクニュバンス:15価の肺炎球菌ワクチン。現在は13価の肺炎球菌ワクチンであるプレベナー13が流通している。
⚫ 再審査期間が新たに付与された品目においても、8件を除き何らかの調査が行われていた。
令和4年度新薬(103件)の
製造販売後調査の状況
再審査期間の新規付与あり(72件)
なし
31件
製造販売後
データベース調査
7件
使用成績調査
45件
全例調査
20件
製造販売後
データベース調査
2件
製造販売後
データベース調査
6件
全例調査
19件
新有効成分含有医薬品(36件)
なし 2件
なし 8件
使用成績調査
39件
全例調査
15件
使用成績調査
17件
8
※特例承認、緊急承認、公知申請のものを除く。
図8 令和4年度の新薬における製販後調査の状況
17
https://www.mhlw.go.jp/content/11121000/001189655.pdf
18
https://www.mhlw.go.jp/content/11121000/001189127.pdf
27
再審査のために本来必要のない使用成績調査が課されているのではないか
使用成績調査について、海外では日本ほど多く活用されておらず、製薬企業や
医療機関にとっての負担が大きいのではないか
全例調査について、医療機関にとっての負担が大きい一方で、有効性や安全性
に係る迅速な情報の収集に資するものになっていないのではないか
製造販売後データベース調査の利用を促進すべきではないか
等の課題を指摘されている。
このため、使用成績調査を含めた製造販売後の追加の安全性管理のあり方を検討し、
それぞれの医薬品の特徴に根ざした合理的な調査計画の策定が可能となる方策につい
て検討した。
(2)検討会における議論
新薬の製造販売後調査の状況(図8)や、最近承認された品目における製造販売後
調査の実施理由、製薬業界から提出された欧米との本邦での追加の安全性監視計画の
比較等などを含めた事務局資料17に基づいて議論が進められた。また、日本製薬工業
協会・柏谷構成員からは、製薬業界の意見18が発表された。
令和4年度の新薬における製販後調査の状況
⚫ 令和4年度に承認された新薬(特例承認、緊急承認、公知申請のものを除く。)において、審査報告書において実施することとされた
製造販売後調査の状況は、以下のグラフのとおりであった。
⚫ 新薬全体としては、全体の7割程度で製造販売後調査が実施されており、その多くで使用成績調査や全例調査が行われていた。
⚫ 新有効成分含有医薬品に限定すると、2件を除き何らかの調査が行われていた。なお、「なし」の2件は、メンクアッドフィ及びバク
ニュバンスであり、いずれも従来品において安全性に係る情報が得られているものであった。
※ メンクアッドフィ:破傷風トキソイドに結合させた4価髄膜炎菌ワクチン。従来はジフテリアトキソイドに結合させた4価髄膜炎菌ワクチンであるメナクトラが流通していた。
※ バクニュバンス:15価の肺炎球菌ワクチン。現在は13価の肺炎球菌ワクチンであるプレベナー13が流通している。
⚫ 再審査期間が新たに付与された品目においても、8件を除き何らかの調査が行われていた。
令和4年度新薬(103件)の
製造販売後調査の状況
再審査期間の新規付与あり(72件)
なし
31件
製造販売後
データベース調査
7件
使用成績調査
45件
全例調査
20件
製造販売後
データベース調査
2件
製造販売後
データベース調査
6件
全例調査
19件
新有効成分含有医薬品(36件)
なし 2件
なし 8件
使用成績調査
39件
全例調査
15件
使用成績調査
17件
8
※特例承認、緊急承認、公知申請のものを除く。
図8 令和4年度の新薬における製販後調査の状況
17
https://www.mhlw.go.jp/content/11121000/001189655.pdf
18
https://www.mhlw.go.jp/content/11121000/001189127.pdf
27