よむ、つかう、まなぶ。
薬ー1参考2 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.はじめに
近年、医薬品産業を取り巻く環境の変化に伴い、ドラッグ・ロスの発生や安定供給の
懸念など、様々な問題が生じていることが指摘されている。特に、海外で承認されてい
る医薬品が日本では開発に着手すらされない、「ドラッグ・ロス」が拡大しているとの
指摘がある。この原因としては、日本の医薬品市場の魅力低下や創薬環境・薬事制度の
違い等があると考えられ、複数の要因が複合的に関わっている。こうした問題意識の下、
日本の医療水準の維持及び向上のために必要な「革新的な医薬品や医療ニーズの高い医
薬品の日本への早期上市」
、「医薬品の安定供給」を確保する観点から、現状の課題を踏
まえ、流通や薬価制度、産業構造の検証などの幅広い議論を行うため、厚生労働省にお
いて「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」が開催さ
れ、令和5年6月9日に報告書がとりまとめられた。
当該報告書においては、医薬品の安定供給、創薬力の強化、ドラッグ・ラグ/ドラッ
グ・ロスの解消、適切な医薬品流通に向けた取組といった観点から幅広く検討課題が整
理された。このうち、主に薬事規制に関係する事項を中心に、具体的な対応策について
の検討を進めることを目的として、「創薬力の強化・安定供給の確保等のための薬事規
制のあり方に関する検討会」を開催することとした(検討会構成員は別紙参照)
。
令和5年7月から令和6年3月までの間、計9回開催された本検討会の議論の結果を
以下のとおり報告する。
2.希少疾病用医薬品の指定のあり方
(1)背景
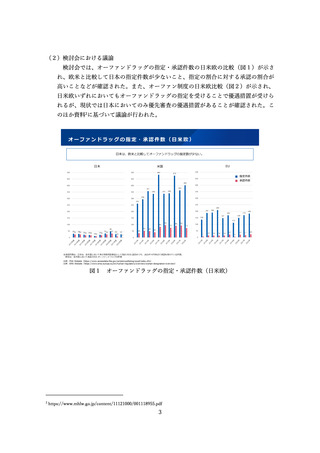
製薬業界からは、日本の希少疾病用医薬品(オーファンドラッグ)の指定範囲は欧
米と比べて狭く、これが日本における開発促進を妨げる要因のひとつとなっていると
指摘されている。希少疾病用医薬品の指定は、開発のインセンティブとなるものであ
るが、指定を拡充することのみをもってドラッグ・ロスの問題が全て解決できるもの
ではない。
その一方、日本製薬工業協会のアンケート結果1によると、希少疾病用医薬品に指定
されなかったことにより開発計画に影響を与えた品目は、86 品目中 13 品目あり、実
際の開発に一定の影響を与えていると考えられる。また、特にベンチャー企業におい
ては、投資の呼び込みに当たって希少疾病用医薬品の指定は大きな要素であると言わ
れている。このため、日本の創薬環境を改善し、多くの革新的な医薬品がより早期に
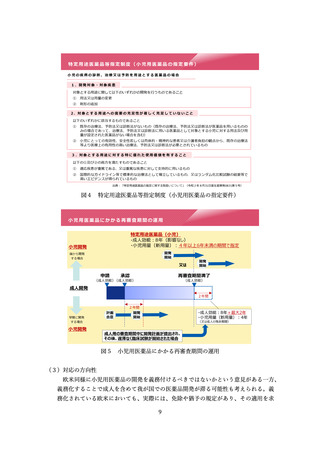
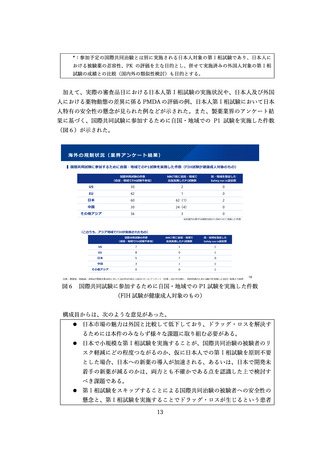
医療現場に届けられるよう、希少疾病用医薬品の指定要件について、「輪切り」の要
件の明確化、医療上の必要性の要件の明確化、指定の早期化と取り消し要件の明確化
の3つの観点から、必要な見直しを検討した。
1
柏谷祐司ら、「国内における希少疾病用医薬品の開発促進に対する課題―希少疾病用医薬品開発企業アンケート結果よ
り―」レギュラトリーサイエンス学会誌 11 (3), 213-221, 2021
2
近年、医薬品産業を取り巻く環境の変化に伴い、ドラッグ・ロスの発生や安定供給の
懸念など、様々な問題が生じていることが指摘されている。特に、海外で承認されてい
る医薬品が日本では開発に着手すらされない、「ドラッグ・ロス」が拡大しているとの
指摘がある。この原因としては、日本の医薬品市場の魅力低下や創薬環境・薬事制度の
違い等があると考えられ、複数の要因が複合的に関わっている。こうした問題意識の下、
日本の医療水準の維持及び向上のために必要な「革新的な医薬品や医療ニーズの高い医
薬品の日本への早期上市」
、「医薬品の安定供給」を確保する観点から、現状の課題を踏
まえ、流通や薬価制度、産業構造の検証などの幅広い議論を行うため、厚生労働省にお
いて「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」が開催さ
れ、令和5年6月9日に報告書がとりまとめられた。
当該報告書においては、医薬品の安定供給、創薬力の強化、ドラッグ・ラグ/ドラッ
グ・ロスの解消、適切な医薬品流通に向けた取組といった観点から幅広く検討課題が整
理された。このうち、主に薬事規制に関係する事項を中心に、具体的な対応策について
の検討を進めることを目的として、「創薬力の強化・安定供給の確保等のための薬事規
制のあり方に関する検討会」を開催することとした(検討会構成員は別紙参照)
。
令和5年7月から令和6年3月までの間、計9回開催された本検討会の議論の結果を
以下のとおり報告する。
2.希少疾病用医薬品の指定のあり方
(1)背景
製薬業界からは、日本の希少疾病用医薬品(オーファンドラッグ)の指定範囲は欧
米と比べて狭く、これが日本における開発促進を妨げる要因のひとつとなっていると
指摘されている。希少疾病用医薬品の指定は、開発のインセンティブとなるものであ
るが、指定を拡充することのみをもってドラッグ・ロスの問題が全て解決できるもの
ではない。
その一方、日本製薬工業協会のアンケート結果1によると、希少疾病用医薬品に指定
されなかったことにより開発計画に影響を与えた品目は、86 品目中 13 品目あり、実
際の開発に一定の影響を与えていると考えられる。また、特にベンチャー企業におい
ては、投資の呼び込みに当たって希少疾病用医薬品の指定は大きな要素であると言わ
れている。このため、日本の創薬環境を改善し、多くの革新的な医薬品がより早期に
医療現場に届けられるよう、希少疾病用医薬品の指定要件について、「輪切り」の要
件の明確化、医療上の必要性の要件の明確化、指定の早期化と取り消し要件の明確化
の3つの観点から、必要な見直しを検討した。
1
柏谷祐司ら、「国内における希少疾病用医薬品の開発促進に対する課題―希少疾病用医薬品開発企業アンケート結果よ
り―」レギュラトリーサイエンス学会誌 11 (3), 213-221, 2021
2