よむ、つかう、まなぶ。
薬ー1参考2 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
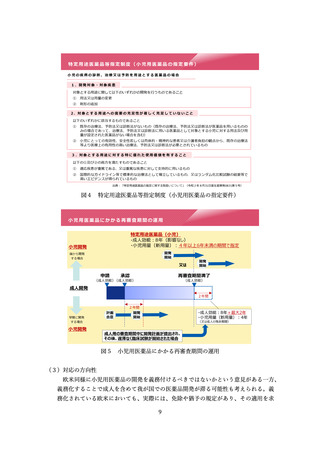
特定用途医薬品等指定制度(小児用医薬品の指定要件)
小児の疾病の診断、治療又は予防を用途とする医薬品の場合
1. 開発対象・対象疾患
対象とする用途に関して以下のいずれかの開発を行うものであること
①
用法又は用量の変更
②
剤形の追加
2. 対象とする用途への需要の充足性が著しく充足していないこと
以下のいずれかに該当するものであること
①
既存の治療法、予防法又は診断法がないもの(既存の治療法、予防法又は診断法が医薬品を用いるものの
みの場合であって、治療法、予防法又は診断法に用いる医薬品として対象とする小児に対する用法及び用
量が設定された医薬品がない場合を含む)
②
小児にとっての有効性、安全性若しくは肉体的・精神的な患者又は介護者負担の観点から、既存の治療法
等より医療上の有用性の高い治療法、予防法又は診断法が必要とされているもの
3. 対象とする用途に対する特に優れた使用価値を有すること
以下の①及び②の両方を満たすものであること
①
適応疾患が重篤である、又は重篤な疾患に対して支持的に用いるもの
②
国際的なガイドライン等で標準的な治療法として確立しているもの、又はランダム化比較試験の結果等で
高いエビデンスが得られているもの
出典:「特定用途医薬品の指定に関する取扱いについて」(令和2年8月31日薬生薬審発0831第5号)
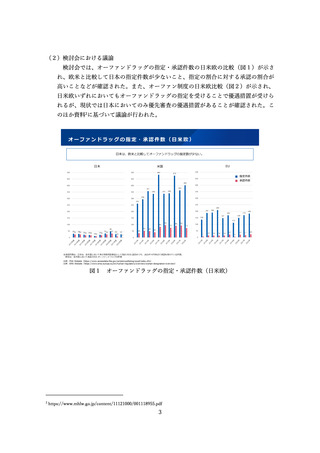
図4 特定用途医薬品等指定制度(小児用医薬品の指定要件)
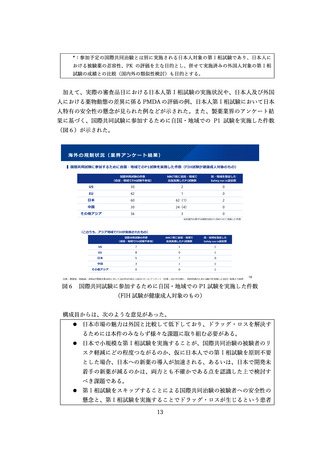
小児用医薬品にかかる再審査期間の運用
特定用途医薬品(小児)
・成人効能:8年(影響なし)
・小児用量(新用量):4年以上6年未満の期間で指定
小児開発
開発
開始
後から開発
する場合
又は
申請
承認
開発
開始
再審査期間満了
(成人効能)(成人効能)
(成人効能)
成人開発
2年間
2年間
早期に開発
する場合
小児開発
計画
合意
・成人効能:8年+最大2年
・小児用量(新用量):4年
開発
開始
(又は成人の残余期間)
成人用の審査期間中に開発計画が提出され、
その後、遅滞なく臨床試験が開始された場合
図5 小児用医薬品にかかる再審査期間の運用
(3)対応の方向性
欧米同様に小児用医薬品の開発を義務付けるべきではないかという意見がある一方、
義務化することで成人を含めて我が国での医薬品開発が滞る可能性も考えられる。義
務化されている欧米においても、実際には、免除や猶予の規定があり、その適用を求
9
小児の疾病の診断、治療又は予防を用途とする医薬品の場合
1. 開発対象・対象疾患
対象とする用途に関して以下のいずれかの開発を行うものであること
①
用法又は用量の変更
②
剤形の追加
2. 対象とする用途への需要の充足性が著しく充足していないこと
以下のいずれかに該当するものであること
①
既存の治療法、予防法又は診断法がないもの(既存の治療法、予防法又は診断法が医薬品を用いるものの
みの場合であって、治療法、予防法又は診断法に用いる医薬品として対象とする小児に対する用法及び用
量が設定された医薬品がない場合を含む)
②
小児にとっての有効性、安全性若しくは肉体的・精神的な患者又は介護者負担の観点から、既存の治療法
等より医療上の有用性の高い治療法、予防法又は診断法が必要とされているもの
3. 対象とする用途に対する特に優れた使用価値を有すること
以下の①及び②の両方を満たすものであること
①
適応疾患が重篤である、又は重篤な疾患に対して支持的に用いるもの
②
国際的なガイドライン等で標準的な治療法として確立しているもの、又はランダム化比較試験の結果等で
高いエビデンスが得られているもの
出典:「特定用途医薬品の指定に関する取扱いについて」(令和2年8月31日薬生薬審発0831第5号)
図4 特定用途医薬品等指定制度(小児用医薬品の指定要件)
小児用医薬品にかかる再審査期間の運用
特定用途医薬品(小児)
・成人効能:8年(影響なし)
・小児用量(新用量):4年以上6年未満の期間で指定
小児開発
開発
開始
後から開発
する場合
又は
申請
承認
開発
開始
再審査期間満了
(成人効能)(成人効能)
(成人効能)
成人開発
2年間
2年間
早期に開発
する場合
小児開発
計画
合意
・成人効能:8年+最大2年
・小児用量(新用量):4年
開発
開始
(又は成人の残余期間)
成人用の審査期間中に開発計画が提出され、
その後、遅滞なく臨床試験が開始された場合
図5 小児用医薬品にかかる再審査期間の運用
(3)対応の方向性
欧米同様に小児用医薬品の開発を義務付けるべきではないかという意見がある一方、
義務化することで成人を含めて我が国での医薬品開発が滞る可能性も考えられる。義
務化されている欧米においても、実際には、免除や猶予の規定があり、その適用を求
9