よむ、つかう、まなぶ。
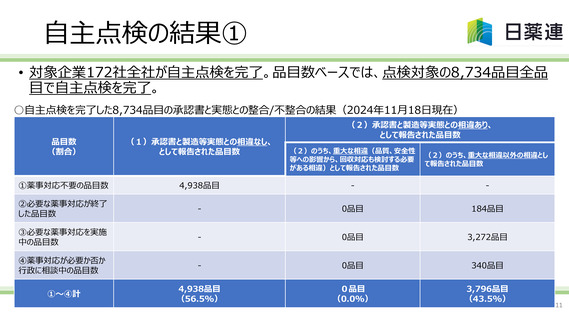
【資料2】後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る自主点検取組み結果について(日本製薬団体連合会) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45464.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第18回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
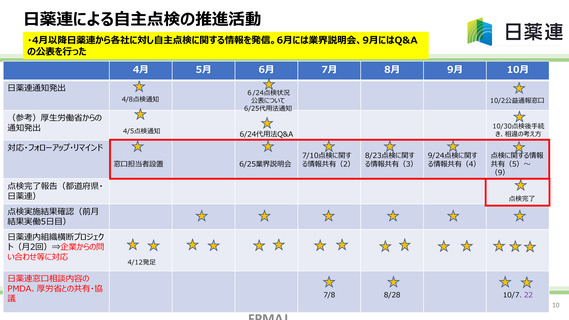
日薬連による自主点検の推進活動
・4月以降日薬連から各社に対し自主点検に関する情報を発信。6月には業界説明会、9月にはQ&A
の公表を行った
4月
日薬連通知発出
(参考)厚生労働省からの
通知発出
5月
6月
4/8点検通知
6/24点検状況
公表について
6/25代用法通知
4/5点検通知
6/24代用法Q&A
対応・フォローアップ・リマインド
窓口担当者設置
6/25業界説明会
7月
8月
9月
10月
10/2公益通報窓口
10/30点検後手続
き、相違の考え方
7/10点検に関す
る情報共有(2)
8/23点検に関す
る情報共有(3)
点検完了報告(都道府県・
日薬連)
9/24点検に関す
る情報共有(4)
点検に関する情報
共有(5)~
(9)
点検完了
点検実施結果確認(前月
結果実働5日目)
日薬連内組織横断プロジェク
ト(月2回)⇒企業からの問
い合わせ等に対応
日薬連窓口相談内容の
PMDA、厚労省との共有・協
議
4/12発足
7/8
8/28
10/7、22
10
・4月以降日薬連から各社に対し自主点検に関する情報を発信。6月には業界説明会、9月にはQ&A
の公表を行った
4月
日薬連通知発出
(参考)厚生労働省からの
通知発出
5月
6月
4/8点検通知
6/24点検状況
公表について
6/25代用法通知
4/5点検通知
6/24代用法Q&A
対応・フォローアップ・リマインド
窓口担当者設置
6/25業界説明会
7月
8月
9月
10月
10/2公益通報窓口
10/30点検後手続
き、相違の考え方
7/10点検に関す
る情報共有(2)
8/23点検に関す
る情報共有(3)
点検完了報告(都道府県・
日薬連)
9/24点検に関す
る情報共有(4)
点検に関する情報
共有(5)~
(9)
点検完了
点検実施結果確認(前月
結果実働5日目)
日薬連内組織横断プロジェク
ト(月2回)⇒企業からの問
い合わせ等に対応
日薬連窓口相談内容の
PMDA、厚労省との共有・協
議
4/12発足
7/8
8/28
10/7、22
10