よむ、つかう、まなぶ。
【資料2】後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る自主点検取組み結果について(日本製薬団体連合会) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45464.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第18回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
自主点検の結果②(相違事案)
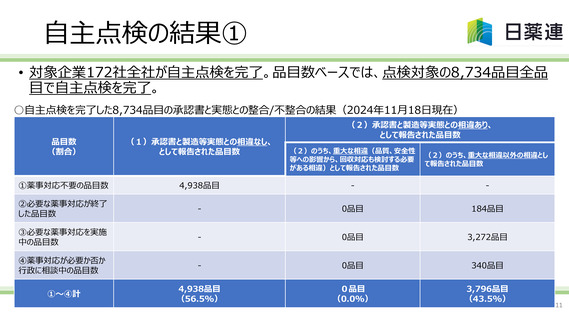
• 重大な相違事案※に該当し、自主回収等の対応が必要な事案の報告はなかった。
• 重大な相違以外の相違事案については、自主点検を完了した8734品目中、3796品目で
報告があった。事案の詳細については現在分析中であるが、これらの事案については、自主回
収等の対応は不要であるものの、必要な薬事対応が速やかに実施される必要がある。代表
的な事案の概要は下表のとおり。
※品質、安全性等への影響から、回収対応も検討する必要がある相違
重大な相違以外の相違として報告された代表的な事例
【製造方法欄】
・承認書の記載通りの原材料及び量を仕込んでいるが、全量を一度に投入し混合するところ、実態としては、少量づつ分割して投入している
・原薬と添加剤を一度に混合機に投入して混合するところ、添加剤と原薬を少し袋の中で混合してから投入し混合している
・添加物名の誤記載(「ビ」と「ピ」)
・承認書と実態とで製造時の圧力は同一ではあるが、単位の表記が異なる
【規格及び試験方法欄】
・pH測定時の試験溶液量について、承認書では10mlとされているところ、pHメータが浸漬できるように20mlとしていた(試料濃度は同一)
・分析装置の部品の規格が承認書と実態で異なっていた(承認書では高速液体クロマトグラフィーのカラム径は「約4mm」と記載されているが、実際に
は「4.6mm」)であった
・品質試験における計算式の誤記(承認書上では分母と分子の項目が逆に記載されていた。現場では正しい計算式に基づき計算していたため、試験
12
結果に問題はない)
FPMAJ
12
• 重大な相違事案※に該当し、自主回収等の対応が必要な事案の報告はなかった。
• 重大な相違以外の相違事案については、自主点検を完了した8734品目中、3796品目で
報告があった。事案の詳細については現在分析中であるが、これらの事案については、自主回
収等の対応は不要であるものの、必要な薬事対応が速やかに実施される必要がある。代表
的な事案の概要は下表のとおり。
※品質、安全性等への影響から、回収対応も検討する必要がある相違
重大な相違以外の相違として報告された代表的な事例
【製造方法欄】
・承認書の記載通りの原材料及び量を仕込んでいるが、全量を一度に投入し混合するところ、実態としては、少量づつ分割して投入している
・原薬と添加剤を一度に混合機に投入して混合するところ、添加剤と原薬を少し袋の中で混合してから投入し混合している
・添加物名の誤記載(「ビ」と「ピ」)
・承認書と実態とで製造時の圧力は同一ではあるが、単位の表記が異なる
【規格及び試験方法欄】
・pH測定時の試験溶液量について、承認書では10mlとされているところ、pHメータが浸漬できるように20mlとしていた(試料濃度は同一)
・分析装置の部品の規格が承認書と実態で異なっていた(承認書では高速液体クロマトグラフィーのカラム径は「約4mm」と記載されているが、実際に
は「4.6mm」)であった
・品質試験における計算式の誤記(承認書上では分母と分子の項目が逆に記載されていた。現場では正しい計算式に基づき計算していたため、試験
12
結果に問題はない)
FPMAJ
12