よむ、つかう、まなぶ。
【資料2】後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る自主点検取組み結果について(日本製薬団体連合会) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45464.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第18回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
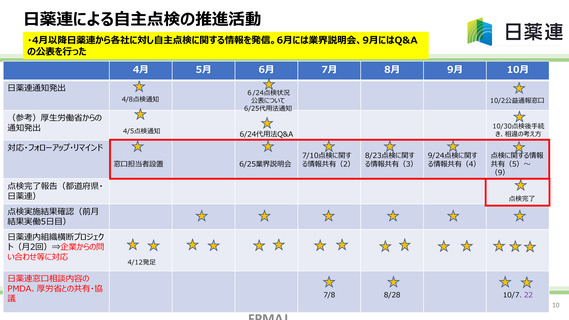
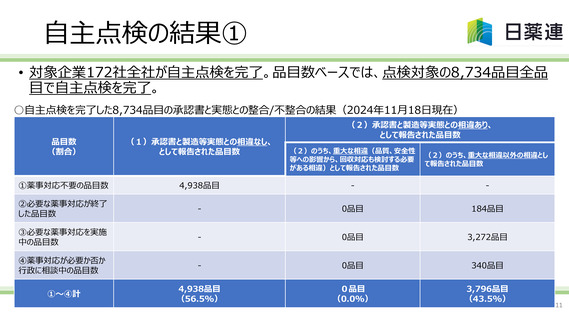
業界団体の取組み
課題認識と取組みについて
承認書と異なる方法での製造及び虚偽の製造記録の別途作成が判明した「化血研問題」を受け、
2016年に厚生労働省からの通知による指示に基づき、製造販売承認書と製造実態の確認(一斉
点検)が行われたが、現時点においても依然として品質不適切事案が発生しており、その中で製造販
売承認書からの逸脱が確認されている。
今後業界団体として、一品目でも後発医薬品の製造販売承認を保有する企業において同様の品質
不適切事案の発生を防止すべく、上記の一斉点検を参考に、さらに、昨今に発生した不適切事案の
検証から新たに点検すべきと考えられた項目等を点検内容に加えた「自主点検実施手順」を作成し、
係る全ての企業が後発医薬品の承認書と製造実態との整合性の自主点検を実施するよう、周知・推
進することで、品質問題の再発防止及び品質問題を発端とする供給不足の連鎖の解消を目指す。
FPMAJ
3
課題認識と取組みについて
承認書と異なる方法での製造及び虚偽の製造記録の別途作成が判明した「化血研問題」を受け、
2016年に厚生労働省からの通知による指示に基づき、製造販売承認書と製造実態の確認(一斉
点検)が行われたが、現時点においても依然として品質不適切事案が発生しており、その中で製造販
売承認書からの逸脱が確認されている。
今後業界団体として、一品目でも後発医薬品の製造販売承認を保有する企業において同様の品質
不適切事案の発生を防止すべく、上記の一斉点検を参考に、さらに、昨今に発生した不適切事案の
検証から新たに点検すべきと考えられた項目等を点検内容に加えた「自主点検実施手順」を作成し、
係る全ての企業が後発医薬品の承認書と製造実態との整合性の自主点検を実施するよう、周知・推
進することで、品質問題の再発防止及び品質問題を発端とする供給不足の連鎖の解消を目指す。
FPMAJ
3