よむ、つかう、まなぶ。
【資料2】後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る自主点検 相違発生原因と再発防止策の策定(日本製薬団体連合会) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49702.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第19回 1/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
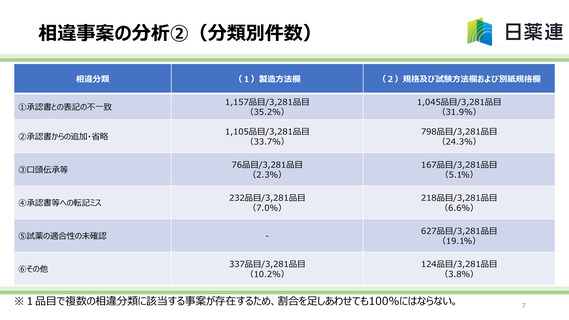
相違事案の分析①(相違の分類)
○各社から報告された相違事案の分析を行った結果、以下の(1)、(2)の観点で、相違が分類化されると考
えられた。なお、相違の考え方が厚労省から自主点検の完了期限の直前に示された※ことから、再度これを踏まえ、
相違事案を整理した結果、相違事案は前回報告した3,796件(43.5%)から、3,281件(37.6%)に変
更となった。
※後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る点検における相違の考え方について(令和6年10月30日付け厚生労働省医薬局医薬品審査管理課、
監視指導・麻薬対策課連名事務連絡)
(1)製造方法欄、試験方法欄の相違に共通する観点
①承認書と関連文書(手順書等)との間で、矛盾(異なる操作等)があった事例(「承認書との表記の不一致」)
②承認書と手順書等との間に矛盾はないが、承認書に記載の範囲を超えた内容が手順書等に記載されていた、あるいは、承認
書の記載を省略した内容が手順書等に記載されていた事例(「承認書からの追加・省略」)
③承認書と手順書等は一致しているが、個々の操作について、文書化されていない微調整作業を行っていた事例(文書化され
ていないが、口頭伝承で微調整作業を実施していた、担当者が承認書の整備は不要と認識していた等)(「口頭伝承等」)
④承認書・関連文書間の転記ミス(「承認書等への転記ミス」)
(2)試験方法欄の相違に特有な観点
⑤試薬の規格が公定書(局方等)で規定されているが、規格に合致した製品が入手できなかった等の事情により、公定書規格
との適合性の確認を行わずに、自社で同等以上と判断できる試薬を利用していた事例(「試薬の適合性の未確認」)
※実際に規格に適合していたか否かにかかわらず、使用している試薬が公定書の規格に適合するかを確認していない場合は、承認書との相違として判断。
6
○各社から報告された相違事案の分析を行った結果、以下の(1)、(2)の観点で、相違が分類化されると考
えられた。なお、相違の考え方が厚労省から自主点検の完了期限の直前に示された※ことから、再度これを踏まえ、
相違事案を整理した結果、相違事案は前回報告した3,796件(43.5%)から、3,281件(37.6%)に変
更となった。
※後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る点検における相違の考え方について(令和6年10月30日付け厚生労働省医薬局医薬品審査管理課、
監視指導・麻薬対策課連名事務連絡)
(1)製造方法欄、試験方法欄の相違に共通する観点
①承認書と関連文書(手順書等)との間で、矛盾(異なる操作等)があった事例(「承認書との表記の不一致」)
②承認書と手順書等との間に矛盾はないが、承認書に記載の範囲を超えた内容が手順書等に記載されていた、あるいは、承認
書の記載を省略した内容が手順書等に記載されていた事例(「承認書からの追加・省略」)
③承認書と手順書等は一致しているが、個々の操作について、文書化されていない微調整作業を行っていた事例(文書化され
ていないが、口頭伝承で微調整作業を実施していた、担当者が承認書の整備は不要と認識していた等)(「口頭伝承等」)
④承認書・関連文書間の転記ミス(「承認書等への転記ミス」)
(2)試験方法欄の相違に特有な観点
⑤試薬の規格が公定書(局方等)で規定されているが、規格に合致した製品が入手できなかった等の事情により、公定書規格
との適合性の確認を行わずに、自社で同等以上と判断できる試薬を利用していた事例(「試薬の適合性の未確認」)
※実際に規格に適合していたか否かにかかわらず、使用している試薬が公定書の規格に適合するかを確認していない場合は、承認書との相違として判断。
6