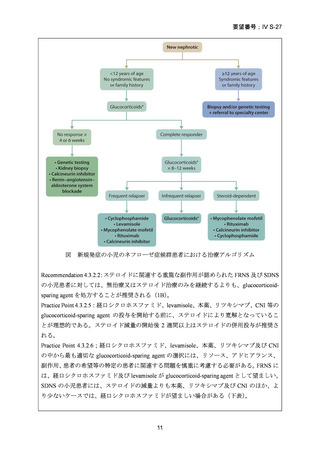
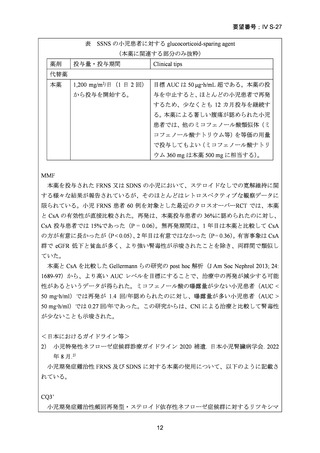
よむ、つかう、まなぶ。
資料4 小児WG[488KB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00035.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第61回 1/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV S-27
り本薬の減量や中止が必要であった。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
先進医療 B として実施されたリツキシマブ治療併用下での多施設共同二重盲検プラセボ
対照無作為化比較試験において、主要評価項目である「治療期間及び追跡期間を通じての
treatment failure 発生までの期間」では、プラセボ群と本薬群との間に統計学的な有意差は
認められなかったものの、treatment failure 発生リスクが約 40%低下する傾向が認められた。
さらに、追加解析として実施された「治療期間中の treatment failure 発生までの期間」では
プラセボ群と比較して本薬群で延長する傾向が認められ、副次評価項目である「治療期間
中の再発率」及び「治療期間中のステロイド投与量」でもプラセボ群と比較して本薬群で
より良好な傾向が認められた。以上の結果を総合的に評価すると、本試験成績から、本薬
の有効性が示唆されていると考える。なお、本試験成績については、第 123 回先進医療技
術審査部会(令和 3 年 10 月 14 日開催)においても「主要評価項目で統計学的有意差がみ
られていないものの、疾患活動性が一定の患者に対しては有用であることが推察されるこ
とから、本適応の薬事承認申請に資すると考えられる」と評価されている。さらに、本試
験成績を踏まえ、小児特発性ネフローゼ症候群診療ガイドライン 2020 補遺において「小児
期発症難治性頻回再発型・ステロイド依存性ネフローゼ症候群に対するリツキシマブ療法
の後療法として、寛解維持のためにミコフェノール酸モフェチルを投与することを提案す
る」とされている。また、海外の教科書や診療ガイドラインにおいても FRNS や SDNS に
対する寛解維持を目的として本薬の使用が推奨されており、国内外の公表文献においても
本薬の有効性が示唆されている。
以上より、医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、
難治性のネフローゼ症候群(頻回再発型あるいはステロイド依存性を示す場合)に対する
リツキシマブ治療後における本薬の寛解維持に係る有効性は期待できると考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
国内外の公表文献等において、FRNS 及び SDNS に対して本薬を投与した際に認められ
た主な有害事象は、好中球減少症、下痢等であった。これらの事象は本薬の既承認の効能・
効果において既知の事象であり、現行の添付文書で注意喚起がなされている。
また、本薬は本邦で 1999 年に承認されて以降、腎移植後の難治性拒絶反応の治療、臓器
移植における拒絶反応の抑制、ループス腎炎及び造血幹細胞移植における移植片対宿主病
の抑制に対して承認されており、日本人における安全性情報が蓄積されている。
16
り本薬の減量や中止が必要であった。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
先進医療 B として実施されたリツキシマブ治療併用下での多施設共同二重盲検プラセボ
対照無作為化比較試験において、主要評価項目である「治療期間及び追跡期間を通じての
treatment failure 発生までの期間」では、プラセボ群と本薬群との間に統計学的な有意差は
認められなかったものの、treatment failure 発生リスクが約 40%低下する傾向が認められた。
さらに、追加解析として実施された「治療期間中の treatment failure 発生までの期間」では
プラセボ群と比較して本薬群で延長する傾向が認められ、副次評価項目である「治療期間
中の再発率」及び「治療期間中のステロイド投与量」でもプラセボ群と比較して本薬群で
より良好な傾向が認められた。以上の結果を総合的に評価すると、本試験成績から、本薬
の有効性が示唆されていると考える。なお、本試験成績については、第 123 回先進医療技
術審査部会(令和 3 年 10 月 14 日開催)においても「主要評価項目で統計学的有意差がみ
られていないものの、疾患活動性が一定の患者に対しては有用であることが推察されるこ
とから、本適応の薬事承認申請に資すると考えられる」と評価されている。さらに、本試
験成績を踏まえ、小児特発性ネフローゼ症候群診療ガイドライン 2020 補遺において「小児
期発症難治性頻回再発型・ステロイド依存性ネフローゼ症候群に対するリツキシマブ療法
の後療法として、寛解維持のためにミコフェノール酸モフェチルを投与することを提案す
る」とされている。また、海外の教科書や診療ガイドラインにおいても FRNS や SDNS に
対する寛解維持を目的として本薬の使用が推奨されており、国内外の公表文献においても
本薬の有効性が示唆されている。
以上より、医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、
難治性のネフローゼ症候群(頻回再発型あるいはステロイド依存性を示す場合)に対する
リツキシマブ治療後における本薬の寛解維持に係る有効性は期待できると考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
国内外の公表文献等において、FRNS 及び SDNS に対して本薬を投与した際に認められ
た主な有害事象は、好中球減少症、下痢等であった。これらの事象は本薬の既承認の効能・
効果において既知の事象であり、現行の添付文書で注意喚起がなされている。
また、本薬は本邦で 1999 年に承認されて以降、腎移植後の難治性拒絶反応の治療、臓器
移植における拒絶反応の抑制、ループス腎炎及び造血幹細胞移植における移植片対宿主病
の抑制に対して承認されており、日本人における安全性情報が蓄積されている。
16