よむ、つかう、まなぶ。
議題2 別紙2先進医療Bの総括報告書に関する評価について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00270.html |
| 出典情報 | 先進医療会議(第141回 3/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
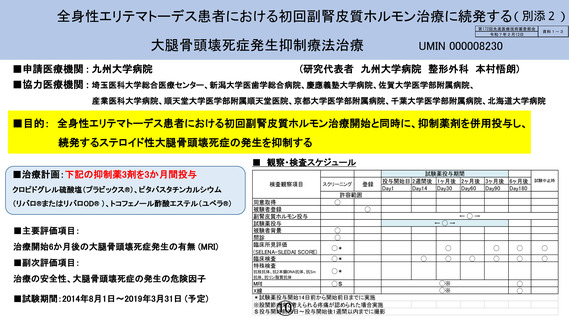
全身性エリテマトーデス患者における初回副腎皮質ホルモン治療に続発する(別添2)
第172回先進医療技術審査部会
令和7年2月13日
大腿骨頭壊死症発生抑制療法治療
■申請医療機関 : 九州大学病院
資料1-3
UMIN 000008230
(研究代表者 九州大学病院 整形外科 本村悟朗)
■協力医療機関 : 埼玉医科大学総合医療センター、新潟大学医歯学総合病院、慶應義塾大学病院、佐賀大学医学部附属病院、
産業医科大学病院、順天堂大学医学部附属順天堂医院、京都大学医学部附属病院、千葉大学医学部附属病院、北海道大学病院
■目的: 全身性エリテマトーデス患者における初回副腎皮質ホルモン治療開始と同時に、抑制薬剤を併用投与し、
続発するステロイド性大腿骨頭壊死症の発生を抑制する
■ 観察・検査スケジュール
■治療計画:下記の抑制薬3剤を3か月間投与
クロピドグレル硫酸塩(プラビックス®)、ピタバスタチンカルシウム
(リバロ®またはリバロOD® )、トコフェノール酢酸エステル(ユベラ®)
■主要評価項目:
治療開始6か月後の大腿骨頭壊死症発生の有無 (MRI)
■副次評価項目:
治療の安全性、大腿骨頭壊死症の発生の危険因子
■試験期間:2014年8月1日~2019年3月31日 (予定)
検査観察項目
同意取得
被験者登録
副腎皮質ホルモン投与
試験薬投与
被験者背景
問診
臨床所見評価
(SELENA-SLEDAI SCORE)
臨床検査
特殊検査
抗核抗体、抗2本鎖DNA抗体、抗Sm
抗体、抗リン脂質抗体
スクリーニング
登録
試験薬投与期間
投与開始日 2週間後 1ヶ月後 2ヶ月後 3ヶ月後 6ヶ月後
Day1
Day14
Day30
Day60
Day90
Day180
許容範囲
◯
◯
←◯→
←◯→
◯
◯
◯*
◯*
◯
◯
◯
◯
◯
◯
◯
◯
◯
◯
◯*
MRI
◯$
X線
*試験薬投与開始14日前から開始前日までに実施
※股関節由来と考えられる疼痛が認められた場合実施
$投与開始前28日~投与開始後1週間以内までに撮影
10
試験中止時
◯※
◯※
◯
◯
第172回先進医療技術審査部会
令和7年2月13日
大腿骨頭壊死症発生抑制療法治療
■申請医療機関 : 九州大学病院
資料1-3
UMIN 000008230
(研究代表者 九州大学病院 整形外科 本村悟朗)
■協力医療機関 : 埼玉医科大学総合医療センター、新潟大学医歯学総合病院、慶應義塾大学病院、佐賀大学医学部附属病院、
産業医科大学病院、順天堂大学医学部附属順天堂医院、京都大学医学部附属病院、千葉大学医学部附属病院、北海道大学病院
■目的: 全身性エリテマトーデス患者における初回副腎皮質ホルモン治療開始と同時に、抑制薬剤を併用投与し、
続発するステロイド性大腿骨頭壊死症の発生を抑制する
■ 観察・検査スケジュール
■治療計画:下記の抑制薬3剤を3か月間投与
クロピドグレル硫酸塩(プラビックス®)、ピタバスタチンカルシウム
(リバロ®またはリバロOD® )、トコフェノール酢酸エステル(ユベラ®)
■主要評価項目:
治療開始6か月後の大腿骨頭壊死症発生の有無 (MRI)
■副次評価項目:
治療の安全性、大腿骨頭壊死症の発生の危険因子
■試験期間:2014年8月1日~2019年3月31日 (予定)
検査観察項目
同意取得
被験者登録
副腎皮質ホルモン投与
試験薬投与
被験者背景
問診
臨床所見評価
(SELENA-SLEDAI SCORE)
臨床検査
特殊検査
抗核抗体、抗2本鎖DNA抗体、抗Sm
抗体、抗リン脂質抗体
スクリーニング
登録
試験薬投与期間
投与開始日 2週間後 1ヶ月後 2ヶ月後 3ヶ月後 6ヶ月後
Day1
Day14
Day30
Day60
Day90
Day180
許容範囲
◯
◯
←◯→
←◯→
◯
◯
◯*
◯*
◯
◯
◯
◯
◯
◯
◯
◯
◯
◯
◯*
MRI
◯$
X線
*試験薬投与開始14日前から開始前日までに実施
※股関節由来と考えられる疼痛が認められた場合実施
$投与開始前28日~投与開始後1週間以内までに撮影
10
試験中止時
◯※
◯※
◯
◯