よむ、つかう、まなぶ。
【資料8】再生医療イノベーションフォーラム(FIRM)提出資料 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26202.html |
| 出典情報 | 革新的医薬品・医療機器創出のための官民対話(第5回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
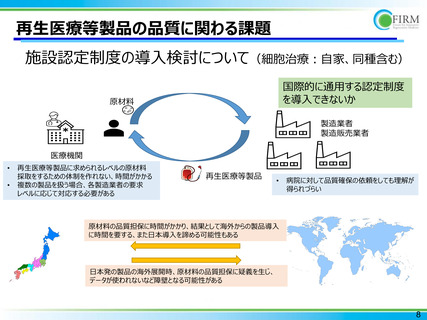
再生医療等製品の提供に関わる課題
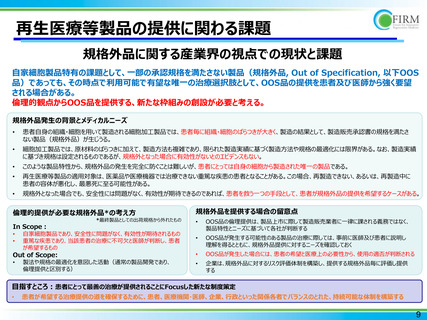
➢ 現状のOOS品提供スキーム:OOS品=未承認品と扱われるため、提供は治験で行われている
OOS品を治験で提供する際の課題
医療機関の視点から
•
•
OOS発生に備え、市販用の体制整備に加え、GCP準拠の治験実施体制の整備が必要
市販・治験の2つの運用が平行し、連携・安全性確保からリスクあり
企業の視点から
•
•
日本で再生医療等製品を上市する上での負荷
日本のみ治験下でのOOS提供であり、日本市場の魅力低下
期間・規模
•
無期限(発売する限り)・製品の市場浸透・施設拡⼤とともに拡⼤
医療機関と企業双方
の努力の元、患者さん
にOOS品を提供して
いるが、持続可能性に
懸念が残る
➢ 未承認品への治療アクセスを患者が希望する場合の現行の枠組み:先の制度利用が不可の場合に次が検討される
治験
先進医療
患者申出療養
いずれも最終的に保険償還を目指す制度設計であり、承認・
保険償還に繋がらないOOS品の倫理供給とそぐわない
倫理的観点からOOS品を提供するため、持続可能な新たな枠組みの創設が必要
<参考:欧米におけるOOS品提供スキーム:患者治療に主眼をおいた制度設計、OOS品の安全性・有効性を評価するものではない>
米国
欧州
Investigational drugsのIND下でのExpanded Access
Commercial lotsのExceptional Administration
重篤で致死的な疾患あるいは状況にあり、治療選択肢のない患者の治療
等に、Investigational drugsの使用を認める。Expanded accessの
主目的は当該治療の安全性や有効性に関する情報収集ではない。
即時に処置が必要な重篤な患者において、他の治療選択肢を考慮した
上で規格外となったATMPの投与が必要と医師が判断した場合に、製造
販売業者は要請のあった医師に対してリスク評価及び規格外であることを
通知し、提供することが可能。
10
➢ 現状のOOS品提供スキーム:OOS品=未承認品と扱われるため、提供は治験で行われている
OOS品を治験で提供する際の課題
医療機関の視点から
•
•
OOS発生に備え、市販用の体制整備に加え、GCP準拠の治験実施体制の整備が必要
市販・治験の2つの運用が平行し、連携・安全性確保からリスクあり
企業の視点から
•
•
日本で再生医療等製品を上市する上での負荷
日本のみ治験下でのOOS提供であり、日本市場の魅力低下
期間・規模
•
無期限(発売する限り)・製品の市場浸透・施設拡⼤とともに拡⼤
医療機関と企業双方
の努力の元、患者さん
にOOS品を提供して
いるが、持続可能性に
懸念が残る
➢ 未承認品への治療アクセスを患者が希望する場合の現行の枠組み:先の制度利用が不可の場合に次が検討される
治験
先進医療
患者申出療養
いずれも最終的に保険償還を目指す制度設計であり、承認・
保険償還に繋がらないOOS品の倫理供給とそぐわない
倫理的観点からOOS品を提供するため、持続可能な新たな枠組みの創設が必要
<参考:欧米におけるOOS品提供スキーム:患者治療に主眼をおいた制度設計、OOS品の安全性・有効性を評価するものではない>
米国
欧州
Investigational drugsのIND下でのExpanded Access
Commercial lotsのExceptional Administration
重篤で致死的な疾患あるいは状況にあり、治療選択肢のない患者の治療
等に、Investigational drugsの使用を認める。Expanded accessの
主目的は当該治療の安全性や有効性に関する情報収集ではない。
即時に処置が必要な重篤な患者において、他の治療選択肢を考慮した
上で規格外となったATMPの投与が必要と医師が判断した場合に、製造
販売業者は要請のあった医師に対してリスク評価及び規格外であることを
通知し、提供することが可能。
10