よむ、つかう、まなぶ。
【資料8】再生医療イノベーションフォーラム(FIRM)提出資料 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26202.html |
| 出典情報 | 革新的医薬品・医療機器創出のための官民対話(第5回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
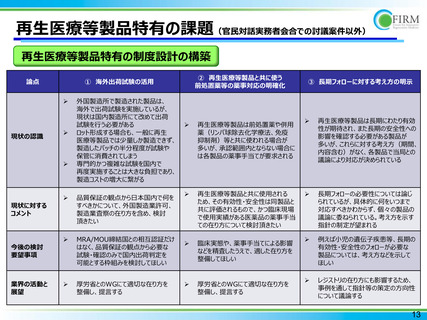
再生医療等製品特有の課題(官民対話実務者会合での討議案件以外)
再生医療等製品特有の制度設計の構築
論点
➢
現状の認識
➢
➢
現状に対する
コメント
今後の検討
要望事項
業界の活動と
展望
② 再生医療等製品と共に使う
前処置薬等の薬事対応の明確化
① 海外出荷試験の活用
外国製造所で製造された製品は、
海外で出荷試験を実施しているが、
現状は国内製造所にて改めて出荷
試験を行う必要がある
ロット形成する場合も、一般に再生
医療等製品では少量しか製造できず、
製造したバッチの半分程度が試験や
保管に消費されてしまう
専門的かつ複雑な試験を国内で
再度実施することは⼤きな負担であり、
製造コストの増⼤に繋がる
➢
品質保証の観点から日本国内で何を
すべきかについて、外国製造業許可、
製造業査察の在り方を含め、検討
頂きたい
➢
MRA/MOU締結国との相互認証だけ
はなく、品質保証の観点から必要な
試験・確認のみで国内出荷判定を
可能とする枠組みを検討してほしい
➢
厚労省とのWGにて適切な在り方を
整備し、提言する
③ 長期フォローに対する考え方の明示
➢
再生医療等製品は前処置薬や併用
薬(リンパ球除去化学療法、免疫
抑制剤)等と共に使われる場合が
多いが、承認範囲内とならない場合に
は各製品の薬事手当てが要求される
➢
再生医療等製品は長期にわたり有効
性が期待され、また長期の安全性への
影響を確認する必要がある製品が
多いが、これらに対する考え方(期間、
内容含む)がなく、各製品で当局との
議論により対応が決められている
➢
再生医療等製品と共に使用される
ため、その有効性・安全性は同製品と
共に評価されるもので、かつ臨床現場
で使用実績がある医薬品の薬事手当
ての在り方について検討頂きたい
➢
長期フォローの必要性については論じ
られているが、具体的に何をいつまで
対応すべきかわからず、個々の製品の
議論に委ねられている。考え方を示す
指針の制定が望まれる
➢
臨床実態や、薬事手当てによる影響
などを精査したうえで、適した在り方を
整備してほしい
➢
例えば小児の遺伝子疾患等、長期の
有効性・安全性のフォローが必要な
製品については、考え方などを示して
ほしい
➢
厚労省とのWGにて適切な在り方を
整備し、提言する
➢
レジストリの在り方にも影響するため、
事例を通して指針等の策定の方向性
について議論する
13
再生医療等製品特有の制度設計の構築
論点
➢
現状の認識
➢
➢
現状に対する
コメント
今後の検討
要望事項
業界の活動と
展望
② 再生医療等製品と共に使う
前処置薬等の薬事対応の明確化
① 海外出荷試験の活用
外国製造所で製造された製品は、
海外で出荷試験を実施しているが、
現状は国内製造所にて改めて出荷
試験を行う必要がある
ロット形成する場合も、一般に再生
医療等製品では少量しか製造できず、
製造したバッチの半分程度が試験や
保管に消費されてしまう
専門的かつ複雑な試験を国内で
再度実施することは⼤きな負担であり、
製造コストの増⼤に繋がる
➢
品質保証の観点から日本国内で何を
すべきかについて、外国製造業許可、
製造業査察の在り方を含め、検討
頂きたい
➢
MRA/MOU締結国との相互認証だけ
はなく、品質保証の観点から必要な
試験・確認のみで国内出荷判定を
可能とする枠組みを検討してほしい
➢
厚労省とのWGにて適切な在り方を
整備し、提言する
③ 長期フォローに対する考え方の明示
➢
再生医療等製品は前処置薬や併用
薬(リンパ球除去化学療法、免疫
抑制剤)等と共に使われる場合が
多いが、承認範囲内とならない場合に
は各製品の薬事手当てが要求される
➢
再生医療等製品は長期にわたり有効
性が期待され、また長期の安全性への
影響を確認する必要がある製品が
多いが、これらに対する考え方(期間、
内容含む)がなく、各製品で当局との
議論により対応が決められている
➢
再生医療等製品と共に使用される
ため、その有効性・安全性は同製品と
共に評価されるもので、かつ臨床現場
で使用実績がある医薬品の薬事手当
ての在り方について検討頂きたい
➢
長期フォローの必要性については論じ
られているが、具体的に何をいつまで
対応すべきかわからず、個々の製品の
議論に委ねられている。考え方を示す
指針の制定が望まれる
➢
臨床実態や、薬事手当てによる影響
などを精査したうえで、適した在り方を
整備してほしい
➢
例えば小児の遺伝子疾患等、長期の
有効性・安全性のフォローが必要な
製品については、考え方などを示して
ほしい
➢
厚労省とのWGにて適切な在り方を
整備し、提言する
➢
レジストリの在り方にも影響するため、
事例を通して指針等の策定の方向性
について議論する
13