よむ、つかう、まなぶ。
医薬品・医療機器等安全性情報(No.393) (2 ページ)
出典
| 公開元URL | https://www.pmda.go.jp/safety/info-services/drugs/calling-attention/safety-info/0162.html |
| 出典情報 | 医薬品・医療機器等安全性情報(No.393)(7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
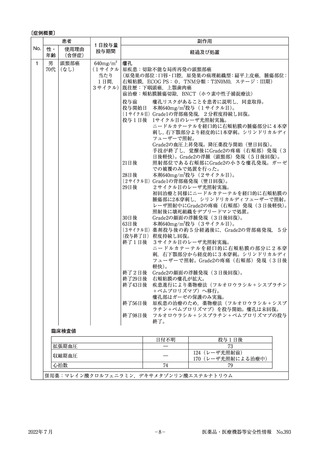
393
厚生労働省医薬・生活衛生局
【情報の概要】
No.
医薬品等
対策
情報の概要
頁
1
重篤副作用疾患別対応マニュア
ルについて
厚生労働省では,平成17年度から平成22年度にかけて「重篤副作
用疾患別対応マニュアル」を作成しており,平成28年度からは,
最新の知見等を踏まえた改定を進めているところです。本稿では, 3
マニュアルの改訂等の進捗,今後の予定及び普及啓発に関する取
組みについて紹介します。
2
セツキシマブ サロタロカンナト
リウム(遺伝子組換え) 他2件
令和4年6月14日に改訂を指導した医薬品の使用上の注意のうち
重要な副作用等について,改訂内容等とともに改訂の根拠となっ
た症例の概要等に関する情報を紹介します。
7
使用上の注意の改訂について(その333)
12
令和4年5月末日現在,市販直後調査の対象品目を紹介します。
15
コ ロ ナ ウ イ ル ス 修 飾 ウリ ジ ン
RNA ワクチン(SARS-CoV-2)
3 (コミナティ筋注,コミナティ筋
注5~11 歳用,スパイクバック
ス筋注) 他7件
4
市販直後調査の対象品目一覧
:緊急安全性情報の配布
:安全性速報の配布
:使用上の注意の改訂
:症例の紹介
厚生労働大臣への副作用等報告は,医薬関係者の業務です。
医師,歯科医師,薬剤師等の医薬関係者は,医薬品,医療機器や再生医療等製品による
副作用,感染症,不具合を知ったときは,直接又は当該医薬品等の製造販売業者を通じて
厚生労働大臣へ報告してください。
なお,薬局及び医薬品の販売の従事者も医薬関係者として,副作用等を報告することが
求められています。
報告の際は,是非,報告受付サイトをご活用ください。
https://www.pmda.go.jp/safety/reports/hcp/0002.html
厚生労働省医薬・生活衛生局
【情報の概要】
No.
医薬品等
対策
情報の概要
頁
1
重篤副作用疾患別対応マニュア
ルについて
厚生労働省では,平成17年度から平成22年度にかけて「重篤副作
用疾患別対応マニュアル」を作成しており,平成28年度からは,
最新の知見等を踏まえた改定を進めているところです。本稿では, 3
マニュアルの改訂等の進捗,今後の予定及び普及啓発に関する取
組みについて紹介します。
2
セツキシマブ サロタロカンナト
リウム(遺伝子組換え) 他2件
令和4年6月14日に改訂を指導した医薬品の使用上の注意のうち
重要な副作用等について,改訂内容等とともに改訂の根拠となっ
た症例の概要等に関する情報を紹介します。
7
使用上の注意の改訂について(その333)
12
令和4年5月末日現在,市販直後調査の対象品目を紹介します。
15
コ ロ ナ ウ イ ル ス 修 飾 ウリ ジ ン
RNA ワクチン(SARS-CoV-2)
3 (コミナティ筋注,コミナティ筋
注5~11 歳用,スパイクバック
ス筋注) 他7件
4
市販直後調査の対象品目一覧
:緊急安全性情報の配布
:安全性速報の配布
:使用上の注意の改訂
:症例の紹介
厚生労働大臣への副作用等報告は,医薬関係者の業務です。
医師,歯科医師,薬剤師等の医薬関係者は,医薬品,医療機器や再生医療等製品による
副作用,感染症,不具合を知ったときは,直接又は当該医薬品等の製造販売業者を通じて
厚生労働大臣へ報告してください。
なお,薬局及び医薬品の販売の従事者も医薬関係者として,副作用等を報告することが
求められています。
報告の際は,是非,報告受付サイトをご活用ください。
https://www.pmda.go.jp/safety/reports/hcp/0002.html