よむ、つかう、まなぶ。
医薬品・医療機器等安全性情報(No.393) (3 ページ)
出典
| 公開元URL | https://www.pmda.go.jp/safety/info-services/drugs/calling-attention/safety-info/0162.html |
| 出典情報 | 医薬品・医療機器等安全性情報(No.393)(7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
重篤副作用疾患別対応
マニュアルについて
1.はじめに
従来の国が実施する安全対策は,医薬品に着目し,医薬品ごとに発生した副作用を収集・ 評価して,
臨床現場に注意喚起する警報発信型,事後対応型の施策が中心でしたが,
①
副作用は,臨床医の専門分野とは異なる臓器にも発生し得ること
②
重篤な副作用の発生頻度は一般に低く,個々の臨床医によっては副作用に遭遇する機会が少ない
場合があり得ること
等により,場合によっては副作用疾患の発見が遅れ,重篤化することが起こり得るという問題がありま
した。
そのため厚生労働省では,これまでの個々の医薬品に着目した従来の副作用対策に加えて,医薬品の
使用により発生する副作用疾患に着目した予測・予防型の副作用対策の整備を行い,さらに副作用発生
機序解明研究等を推進するため,平成17年より「重篤副作用疾患総合対策事業」
(以下「本事業」という。
令和3年度からは「重篤副作用疾患別対応マニュアル整備事業」として継続中。
)を実施しております。
「重篤副作用疾患別対応マニュアル」(以下「マニュアル」という。
)は,本事業において,平成17年
度から平成22年度にかけて,学術論文,各種ガイドライン,厚生労働科学研究事業報告書,独立行政法
人医薬品医療機器総合機構の保健福祉事業報告書等を参考に,厚生労働省の委託により,関係学会にお
いてマニュアル作成委員会を組織し,一般社団法人日本病院薬剤師会とともに議論を重ねて作成された
マニュアル案をもとに,重篤副作用総合対策検討会で検討され,取りまとめられたものです。
平成28年度からは,作成から時間が経過した各マニュアルについて,より一層の活用を推進するため,
関係学会等の協力を得ながら,最新の知見を踏まえた改定等を5年間で実施しており,さらにその後も
継続し,必要に応じて更なる改定や新規作成等の他,マニュアルの普及啓発に向けた取り組み等を実施
しています。
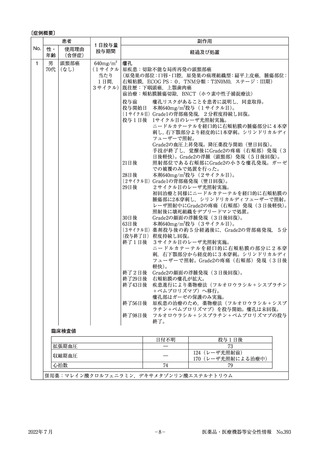
2.改定等の進捗
令和2年度には以下のマニュアルについて改定等を行い,令和3年10月15日に開催された重篤副作用
総合対策検討会での報告・検討を経て,令和4年2月に公表しました。
医薬品・医療機器等安全性情報
No.393
-3-
2022年7月
重篤副作用疾患別対応
マニュアルについて
1.はじめに
従来の国が実施する安全対策は,医薬品に着目し,医薬品ごとに発生した副作用を収集・ 評価して,
臨床現場に注意喚起する警報発信型,事後対応型の施策が中心でしたが,
①
副作用は,臨床医の専門分野とは異なる臓器にも発生し得ること
②
重篤な副作用の発生頻度は一般に低く,個々の臨床医によっては副作用に遭遇する機会が少ない
場合があり得ること
等により,場合によっては副作用疾患の発見が遅れ,重篤化することが起こり得るという問題がありま
した。
そのため厚生労働省では,これまでの個々の医薬品に着目した従来の副作用対策に加えて,医薬品の
使用により発生する副作用疾患に着目した予測・予防型の副作用対策の整備を行い,さらに副作用発生
機序解明研究等を推進するため,平成17年より「重篤副作用疾患総合対策事業」
(以下「本事業」という。
令和3年度からは「重篤副作用疾患別対応マニュアル整備事業」として継続中。
)を実施しております。
「重篤副作用疾患別対応マニュアル」(以下「マニュアル」という。
)は,本事業において,平成17年
度から平成22年度にかけて,学術論文,各種ガイドライン,厚生労働科学研究事業報告書,独立行政法
人医薬品医療機器総合機構の保健福祉事業報告書等を参考に,厚生労働省の委託により,関係学会にお
いてマニュアル作成委員会を組織し,一般社団法人日本病院薬剤師会とともに議論を重ねて作成された
マニュアル案をもとに,重篤副作用総合対策検討会で検討され,取りまとめられたものです。
平成28年度からは,作成から時間が経過した各マニュアルについて,より一層の活用を推進するため,
関係学会等の協力を得ながら,最新の知見を踏まえた改定等を5年間で実施しており,さらにその後も
継続し,必要に応じて更なる改定や新規作成等の他,マニュアルの普及啓発に向けた取り組み等を実施
しています。
2.改定等の進捗
令和2年度には以下のマニュアルについて改定等を行い,令和3年10月15日に開催された重篤副作用
総合対策検討会での報告・検討を経て,令和4年2月に公表しました。
医薬品・医療機器等安全性情報
No.393
-3-
2022年7月