よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
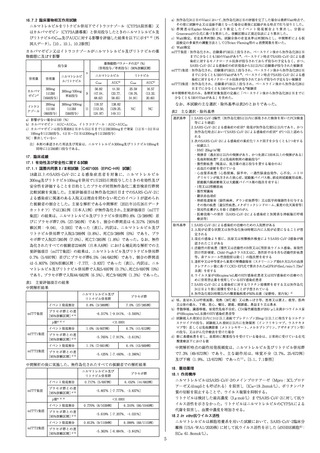
**2021年11月改訂(第 5 版)
*2021年 6 月改訂(第 4 版)
注意 ― 特例承認医薬品
貯法:室温保存
有効期間:36ヵ月
日本標準商品分類番号
87625
承認番号
販売開始
30200AMX00455000
2020年 5 月
抗ウイルス剤
レムデシビル・注射用凍結乾燥製剤
処方箋医薬品注)
注)注意―医師等の処方箋により使用すること
8.2 Infusion Reaction、アナフィラキシーを含む過敏症があら
われることがあるので、患者の状態を十分に観察するとともに、
異常が認められた場合には直ちに投与を中止し、適切な処置を
行うこと。また、これらの発現を回避できる可能性があるため、
本剤の緩徐な投与を考慮すること。[7.1、11.1.2参照]
*8.3 添加剤スルホブチルエーテルβ-シクロデキストリンナトリ
ウムにより腎機能障害があらわれるおそれがあるので、投与前
及び投与中は定期的に腎機能検査を行い、患者の状態を十分に
観察すること。[9.2参照]
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
3. 組成・性状
*3.1 組成
販売名
ベクルリー点滴静注用100mg
有効成分
レムデシビル
含量注1)
100mg
(1バイアル中)
スルホブチルエーテルβ-シクロデキストリンナ
添加剤注2)
トリウム3146mg、pH調節剤
注1)本品は注射液吸引時の損失を考慮して、5%過量充填されているので、実充填量は
105mgである。
注2)実充填量を示す。
3.2 製剤の性状
販売名
性状・剤形
pH
浸透圧比注2)
ベクルリー点滴静注用100mg
白色~微黄白色~黄色の塊
3.0~4.0注1)
約1.1(日局生理食塩液に対する比)
注1)本品1バイアルに19mLの注射用水を加えて溶かした液
注2)100mg又は200mgのレムデシビルを生理食塩液(250mL)に溶かした液
4. 効能又は効果
SARS-CoV-2による感染症
5. 効能又は効果に関連する注意
臨床試験等における主な投与経験を踏まえ、SARS-CoV-2によ
る肺炎を有する患者を対象に投与を行うこと。[17.1.1参照]
6. 用法及び用量
通常、成人及び体重40kg以上の小児にはレムデシビルとして、
投与初日に200mgを、投与2日目以降は100mgを1日1回点滴静
注する。
通常、体重3.5kg以上40kg未満の小児にはレムデシビルとして、
投与初日に5mg/kgを、投与2日目以降は2.5mg/kgを1日1回点
滴静注する。
なお、総投与期間は10日までとする。
7. 用法及び用量に関連する注意
7.1 生理食塩液に添加し、30分から120分かけて点滴静注するこ
と。
[8.2、14.1参照]
7.2 目安として、5日目まで投与し、症状の改善が認められない
場合には10日目まで投与する。
7.3 小児患者における薬物動態は不明である。小児患者における
国内承認用法・用量は、生理学的薬物動態モデルによるシミュ
レーションに基づいて決定されたものであることに留意するこ
と。
[9.7、16.6.1参照]
8. 重要な基本的注意
8.1 肝機能障害があらわれることがあるので、投与前及び投与中
は定期的に肝機能検査を行い、患者の状態を十分に観察するこ
と。
[9.3.1、11.1.1参照]
-1-
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
添加剤スルホブチルエーテルβ-シクロデキストリンナトリウ
ムの尿細管への蓄積により、腎機能障害が悪化するおそれがあ
る。非臨床試験でレムデシビルに腎尿細管への影響が認められ
ている。腎機能障害を有する患者を対象とした臨床試験は実施
していない。
[8.3、15.2、16.6.2参照]
9.2.1 重度の腎機能障害(成人、乳児、幼児及び小児はeGFRが
30mL/min/1.73m2未満、正期産新生児(7日~28日)では血清
クレアチニン1mg/dL以上)の患者
投与は推奨しない。治療上の有益性が危険性を上回ると判断さ
れる場合にのみ投与を考慮すること。[9.7、17.1.1参照]
9.3 肝機能障害患者
9.3.1 ALTが基準範囲上限の5倍以上の患者
投与しないことが望ましい。肝機能障害が悪化するおそれがあ
る。肝機能障害を有する患者を対象とした臨床試験は実施して
いない。
[8.1、11.1.1、16.6.3、17.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。妊娠
ラット及びウサギを用いた胚・胎児への影響に関する試験で、
レムデシビル20mg/kgまでを静脈内投与した場合(主要血中代
謝物(ヌクレオシド類似体)の全身曝露量(AUC)が国内承
認用量投与時曝露量の4倍に相当)、胚・胎児発生に対する影響
は認められなかった。雌ラットを用いた受胎能及び初期胚発生
への影響に関する試験において、レムデシビル10mg/kgを静脈
内投与した場合(主要血中代謝物(ヌクレオシド類似体)の全
身曝露量(AUC)が国内承認用量投与時曝露量の1.3倍に相
当)、黄体数・胚着床数・生存胚数の減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又
は中止を検討すること。動物実験(ラット)において、レムデ
シビル及びその代謝物が乳汁中へ移行することが認められている。
9.7 小児等
治療上の有益性が危険性を上回ると判断される場合にのみ投与
すること。小児等を対象とした臨床試験は実施していない。添
加剤スルホブチルエーテルβ-シクロデキストリンナトリウム
は腎尿細管に対して毒性を有し、腎臓が発育段階にある2歳未
満の小児に対する影響は不明である。[9.2参照]
小児患者における薬物動態は不明である。小児患者における国
内承認用法・用量は、生理学的薬物動態モデルによるシミュ
レーションに基づいて決定された。
[7.3、16.6.1参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機
能が低下しており、既往歴や合併症を伴っていることが多くみ
られる。
*2021年 6 月改訂(第 4 版)
注意 ― 特例承認医薬品
貯法:室温保存
有効期間:36ヵ月
日本標準商品分類番号
87625
承認番号
販売開始
30200AMX00455000
2020年 5 月
抗ウイルス剤
レムデシビル・注射用凍結乾燥製剤
処方箋医薬品注)
注)注意―医師等の処方箋により使用すること
8.2 Infusion Reaction、アナフィラキシーを含む過敏症があら
われることがあるので、患者の状態を十分に観察するとともに、
異常が認められた場合には直ちに投与を中止し、適切な処置を
行うこと。また、これらの発現を回避できる可能性があるため、
本剤の緩徐な投与を考慮すること。[7.1、11.1.2参照]
*8.3 添加剤スルホブチルエーテルβ-シクロデキストリンナトリ
ウムにより腎機能障害があらわれるおそれがあるので、投与前
及び投与中は定期的に腎機能検査を行い、患者の状態を十分に
観察すること。[9.2参照]
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
3. 組成・性状
*3.1 組成
販売名
ベクルリー点滴静注用100mg
有効成分
レムデシビル
含量注1)
100mg
(1バイアル中)
スルホブチルエーテルβ-シクロデキストリンナ
添加剤注2)
トリウム3146mg、pH調節剤
注1)本品は注射液吸引時の損失を考慮して、5%過量充填されているので、実充填量は
105mgである。
注2)実充填量を示す。
3.2 製剤の性状
販売名
性状・剤形
pH
浸透圧比注2)
ベクルリー点滴静注用100mg
白色~微黄白色~黄色の塊
3.0~4.0注1)
約1.1(日局生理食塩液に対する比)
注1)本品1バイアルに19mLの注射用水を加えて溶かした液
注2)100mg又は200mgのレムデシビルを生理食塩液(250mL)に溶かした液
4. 効能又は効果
SARS-CoV-2による感染症
5. 効能又は効果に関連する注意
臨床試験等における主な投与経験を踏まえ、SARS-CoV-2によ
る肺炎を有する患者を対象に投与を行うこと。[17.1.1参照]
6. 用法及び用量
通常、成人及び体重40kg以上の小児にはレムデシビルとして、
投与初日に200mgを、投与2日目以降は100mgを1日1回点滴静
注する。
通常、体重3.5kg以上40kg未満の小児にはレムデシビルとして、
投与初日に5mg/kgを、投与2日目以降は2.5mg/kgを1日1回点
滴静注する。
なお、総投与期間は10日までとする。
7. 用法及び用量に関連する注意
7.1 生理食塩液に添加し、30分から120分かけて点滴静注するこ
と。
[8.2、14.1参照]
7.2 目安として、5日目まで投与し、症状の改善が認められない
場合には10日目まで投与する。
7.3 小児患者における薬物動態は不明である。小児患者における
国内承認用法・用量は、生理学的薬物動態モデルによるシミュ
レーションに基づいて決定されたものであることに留意するこ
と。
[9.7、16.6.1参照]
8. 重要な基本的注意
8.1 肝機能障害があらわれることがあるので、投与前及び投与中
は定期的に肝機能検査を行い、患者の状態を十分に観察するこ
と。
[9.3.1、11.1.1参照]
-1-
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
添加剤スルホブチルエーテルβ-シクロデキストリンナトリウ
ムの尿細管への蓄積により、腎機能障害が悪化するおそれがあ
る。非臨床試験でレムデシビルに腎尿細管への影響が認められ
ている。腎機能障害を有する患者を対象とした臨床試験は実施
していない。
[8.3、15.2、16.6.2参照]
9.2.1 重度の腎機能障害(成人、乳児、幼児及び小児はeGFRが
30mL/min/1.73m2未満、正期産新生児(7日~28日)では血清
クレアチニン1mg/dL以上)の患者
投与は推奨しない。治療上の有益性が危険性を上回ると判断さ
れる場合にのみ投与を考慮すること。[9.7、17.1.1参照]
9.3 肝機能障害患者
9.3.1 ALTが基準範囲上限の5倍以上の患者
投与しないことが望ましい。肝機能障害が悪化するおそれがあ
る。肝機能障害を有する患者を対象とした臨床試験は実施して
いない。
[8.1、11.1.1、16.6.3、17.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。妊娠
ラット及びウサギを用いた胚・胎児への影響に関する試験で、
レムデシビル20mg/kgまでを静脈内投与した場合(主要血中代
謝物(ヌクレオシド類似体)の全身曝露量(AUC)が国内承
認用量投与時曝露量の4倍に相当)、胚・胎児発生に対する影響
は認められなかった。雌ラットを用いた受胎能及び初期胚発生
への影響に関する試験において、レムデシビル10mg/kgを静脈
内投与した場合(主要血中代謝物(ヌクレオシド類似体)の全
身曝露量(AUC)が国内承認用量投与時曝露量の1.3倍に相
当)、黄体数・胚着床数・生存胚数の減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又
は中止を検討すること。動物実験(ラット)において、レムデ
シビル及びその代謝物が乳汁中へ移行することが認められている。
9.7 小児等
治療上の有益性が危険性を上回ると判断される場合にのみ投与
すること。小児等を対象とした臨床試験は実施していない。添
加剤スルホブチルエーテルβ-シクロデキストリンナトリウム
は腎尿細管に対して毒性を有し、腎臓が発育段階にある2歳未
満の小児に対する影響は不明である。[9.2参照]
小児患者における薬物動態は不明である。小児患者における国
内承認用法・用量は、生理学的薬物動態モデルによるシミュ
レーションに基づいて決定された。
[7.3、16.6.1参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機
能が低下しており、既往歴や合併症を伴っていることが多くみ
られる。