よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
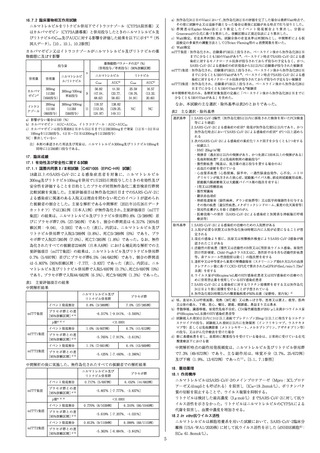
**2022年1月改訂(第4版)
*2022年1月改訂(第3版)
貯法:2~8℃で保存
**有効期間:18ヵ月
注意−特例承認医薬品
抗SARS-CoV-2モノクローナル抗体
ソトロビマブ(遺伝子組換え)注
規制区分:
生物由来製品、
注)
処方箋医薬品
日本標準商品分類番号
87625
承認番号 30300AMX00434
販売開始
2021年9月
本剤は、本邦で特例承認されたものであり、承認時において一部の試験成績は評価されていないことから、本剤の使用に当たっては、
あらかじめ患者又は代諾者にその旨を説明し、文書による同意を得てから投与すること。
注)注意−医師等の処方箋により使用すること
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。生殖
発生毒性試験は実施していない。一般にヒトIgGは胎盤を通過す
ることが知られている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は
中止を検討すること。本剤のヒト乳汁への移行性については不明で
あるが、一般にヒトIgGは乳汁中へ移行することが知られている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理
機能が低下している。
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し重篤な過敏症の既往歴のある患者
3. 組成・性状
3.1 組成
販売名
有効成分
添加剤
ゼビュディ点滴静注液500mg
1バイアル(8mL)中
ソトロビマブ(遺伝子組換え)500mg注)
L-ヒスチジン 12.08mg
L-ヒスチジン塩酸塩水和物 17.2mg
精製白糖 560mg
ポリソルベート80 3.2mg
L-メチオニン 6.0mg
本剤は、チャイニーズハムスター卵巣細胞を用いて製造される。
注)注射液吸引時の損失を考慮し、1バイアルから500mgを注射す
るに足る量を確保するために過量充てんされている。
3.2 製剤の性状
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常
が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 重篤な過敏症(頻度不明)
アナフィラキシーを含む重篤な過敏症があらわれることがあるの
で、観察を十分に行い、異常が認められた場合には本剤の投与
を直ちに中止し、薬物治療等の適切な処置を行うこと。
[8.参照]
11.1.2 Infusion reaction(頻度不明)
Infusion reaction(発熱、呼吸困難、酸素飽和度低下、悪寒、
嘔気、不整脈、胸痛、胸部不快感、脱力感、精神状態変化、頭
痛、気管支痙攣、低血圧、高血圧、咽頭炎、蕁麻疹、そう痒、
筋痛、めまい等)があらわれることがある。異常が認められた
場合には投与速度の減速、投与中断又は投与中止し、アドレナ
リン、副腎皮質ステロイド薬、抗ヒスタミン薬を投与するなど
適切な処置を行うとともに症状が回復するまで患者の状態を十
分に観察すること。
11.2 その他の副作用
販売名
ゼビュディ点滴静注液500mg
剤形・性状 無色~黄色又は褐色澄明の注射液
pH
5.5~6.5
浸透圧比 0.8~1.2(生理食塩液に対する比)
4. 効能又は効果
SARS-CoV-2による感染症
5. 効能又は効果に関連する注意
5.1 臨床試験における主な投与経験を踏まえ、SARS-CoV-2によ
る感染症の重症化リスク因子を有し、酸素投与を要しない患者
を対象に投与を行うこと。[17.1.1参照]
5.2 他の抗SARS-CoV-2モノクローナル抗体が投与された高流量
酸素又は人工呼吸器管理を要する患者において症状が悪化した
との報告がある。[15.1参照]
5.3 本剤の中和活性が低いSARS-CoV-2変異株に対しては本剤の
有効性が期待できない可能性があるため、SARS-CoV-2の最新
の流行株の情報を踏まえ、本剤投与の適切性を検討すること。
[18.2参照]
1%未満
過敏症
発疹、皮膚反応
胃腸障害
悪心
一般・全身障害および 注入部位疼痛、疼痛
投与部位の状態
血中重炭酸塩減少、C-反応性蛋白増
臨床検査
加、AST増加、ALP増加、γ-GTP増
加、酸素飽和度低下
神経系障害
頭痛、味覚不全
精神障害
不眠症
6. 用法及び用量
通常、成人及び12歳以上かつ体重40kg以上の小児には、ソトロ
ビマブ(遺伝子組換え)として500mgを単回点滴静注する。
7. 用法及び用量に関連する注意
SARS-CoV-2による感染症の症状が発現してから速やかに投与
すること。症状発現から1週間程度までを目安に投与することが
望ましい。[17.1.1参照]
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は生理食塩液又は5%ブドウ糖注射液で用時希釈して
使用すること。希釈前に生理食塩液又は5%ブドウ糖注射液の点
滴バッグ(50mL又は100mL)から8mLをあらかじめ抜き取って
おくこと。
8. 重要な基本的注意
アナフィラキシーを含む重篤な過敏症があらわれることがある
ので、本剤投与中はアナフィラキシーショック、アナフィラキ
シーに対する適切な薬物治療(アドレナリン、副腎皮質ステロ
イド薬、抗ヒスタミン薬等)や緊急処置を直ちに実施できるよ
うにしておくこと。また、投与終了後も症状のないことを確認
すること。[11.1.1参照]
-1-
*2022年1月改訂(第3版)
貯法:2~8℃で保存
**有効期間:18ヵ月
注意−特例承認医薬品
抗SARS-CoV-2モノクローナル抗体
ソトロビマブ(遺伝子組換え)注
規制区分:
生物由来製品、
注)
処方箋医薬品
日本標準商品分類番号
87625
承認番号 30300AMX00434
販売開始
2021年9月
本剤は、本邦で特例承認されたものであり、承認時において一部の試験成績は評価されていないことから、本剤の使用に当たっては、
あらかじめ患者又は代諾者にその旨を説明し、文書による同意を得てから投与すること。
注)注意−医師等の処方箋により使用すること
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。生殖
発生毒性試験は実施していない。一般にヒトIgGは胎盤を通過す
ることが知られている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は
中止を検討すること。本剤のヒト乳汁への移行性については不明で
あるが、一般にヒトIgGは乳汁中へ移行することが知られている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理
機能が低下している。
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し重篤な過敏症の既往歴のある患者
3. 組成・性状
3.1 組成
販売名
有効成分
添加剤
ゼビュディ点滴静注液500mg
1バイアル(8mL)中
ソトロビマブ(遺伝子組換え)500mg注)
L-ヒスチジン 12.08mg
L-ヒスチジン塩酸塩水和物 17.2mg
精製白糖 560mg
ポリソルベート80 3.2mg
L-メチオニン 6.0mg
本剤は、チャイニーズハムスター卵巣細胞を用いて製造される。
注)注射液吸引時の損失を考慮し、1バイアルから500mgを注射す
るに足る量を確保するために過量充てんされている。
3.2 製剤の性状
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常
が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 重篤な過敏症(頻度不明)
アナフィラキシーを含む重篤な過敏症があらわれることがあるの
で、観察を十分に行い、異常が認められた場合には本剤の投与
を直ちに中止し、薬物治療等の適切な処置を行うこと。
[8.参照]
11.1.2 Infusion reaction(頻度不明)
Infusion reaction(発熱、呼吸困難、酸素飽和度低下、悪寒、
嘔気、不整脈、胸痛、胸部不快感、脱力感、精神状態変化、頭
痛、気管支痙攣、低血圧、高血圧、咽頭炎、蕁麻疹、そう痒、
筋痛、めまい等)があらわれることがある。異常が認められた
場合には投与速度の減速、投与中断又は投与中止し、アドレナ
リン、副腎皮質ステロイド薬、抗ヒスタミン薬を投与するなど
適切な処置を行うとともに症状が回復するまで患者の状態を十
分に観察すること。
11.2 その他の副作用
販売名
ゼビュディ点滴静注液500mg
剤形・性状 無色~黄色又は褐色澄明の注射液
pH
5.5~6.5
浸透圧比 0.8~1.2(生理食塩液に対する比)
4. 効能又は効果
SARS-CoV-2による感染症
5. 効能又は効果に関連する注意
5.1 臨床試験における主な投与経験を踏まえ、SARS-CoV-2によ
る感染症の重症化リスク因子を有し、酸素投与を要しない患者
を対象に投与を行うこと。[17.1.1参照]
5.2 他の抗SARS-CoV-2モノクローナル抗体が投与された高流量
酸素又は人工呼吸器管理を要する患者において症状が悪化した
との報告がある。[15.1参照]
5.3 本剤の中和活性が低いSARS-CoV-2変異株に対しては本剤の
有効性が期待できない可能性があるため、SARS-CoV-2の最新
の流行株の情報を踏まえ、本剤投与の適切性を検討すること。
[18.2参照]
1%未満
過敏症
発疹、皮膚反応
胃腸障害
悪心
一般・全身障害および 注入部位疼痛、疼痛
投与部位の状態
血中重炭酸塩減少、C-反応性蛋白増
臨床検査
加、AST増加、ALP増加、γ-GTP増
加、酸素飽和度低下
神経系障害
頭痛、味覚不全
精神障害
不眠症
6. 用法及び用量
通常、成人及び12歳以上かつ体重40kg以上の小児には、ソトロ
ビマブ(遺伝子組換え)として500mgを単回点滴静注する。
7. 用法及び用量に関連する注意
SARS-CoV-2による感染症の症状が発現してから速やかに投与
すること。症状発現から1週間程度までを目安に投与することが
望ましい。[17.1.1参照]
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は生理食塩液又は5%ブドウ糖注射液で用時希釈して
使用すること。希釈前に生理食塩液又は5%ブドウ糖注射液の点
滴バッグ(50mL又は100mL)から8mLをあらかじめ抜き取って
おくこと。
8. 重要な基本的注意
アナフィラキシーを含む重篤な過敏症があらわれることがある
ので、本剤投与中はアナフィラキシーショック、アナフィラキ
シーに対する適切な薬物治療(アドレナリン、副腎皮質ステロ
イド薬、抗ヒスタミン薬等)や緊急処置を直ちに実施できるよ
うにしておくこと。また、投与終了後も症状のないことを確認
すること。[11.1.1参照]
-1-