資料1-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について (101 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
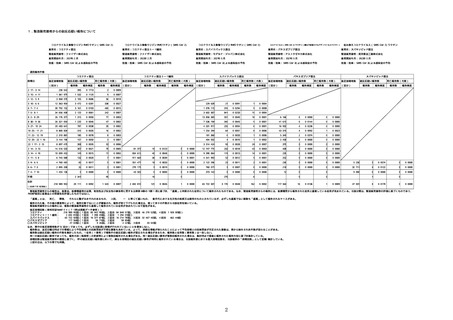
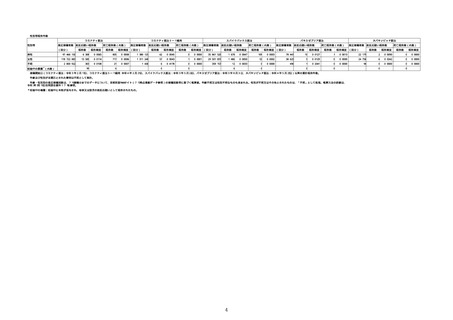
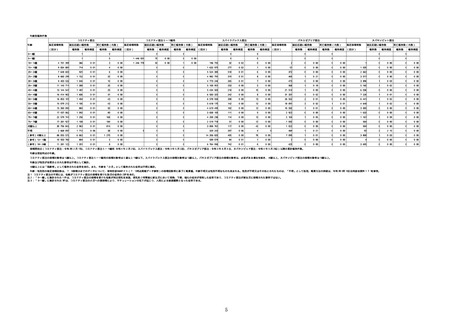
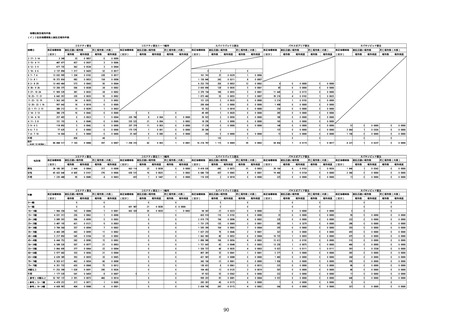
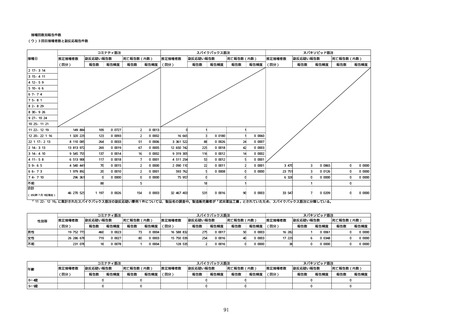
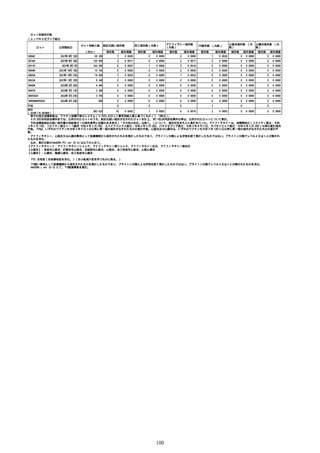
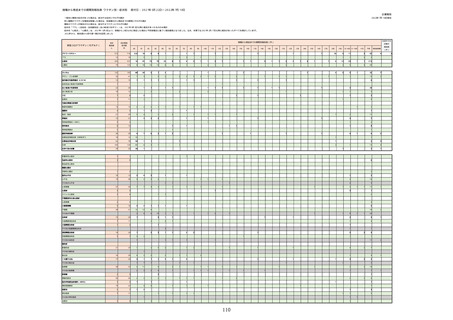
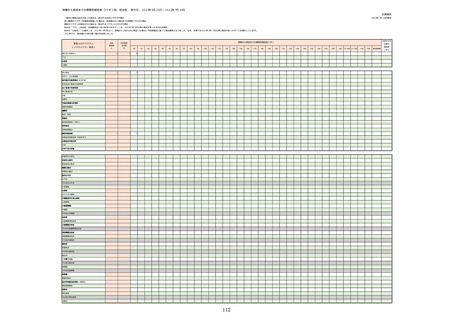
(オ)ヌバキソビッド筋注
ロット
出荷開始日
副反応疑い報告数
ロット別納入数
(回分)
報告数
※
アナフィラシー報告数
(内数)
死亡報告数(内数)
報告頻度
報告数
報告頻度
報告数
※
報告頻度
報告数
※
心筋炎報告数 (内
数)
TTS報告数※(内数)
報告頻度
報告数
心膜炎報告数 (内
数)
報告頻度
報告数
報告頻度
NP001
2022年5月23日
270,640
6
0.0022%
0
0.0000%
3
0.0011%
0
0.0000%
0
0.0000%
0
0.0000%
0
2022年5月24日
1,000
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
NP002
2022年6月21日
15,130
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
0
0.0000%
-
-
2
-
0
-
1
-
0
-
0
-
0
-
-
286,770
8
0.0028%
0
0.0000%
4
0.0014%
0
0.0000%
0
0.0000%
0
0.0000%
不明
合計
(2022年7月10日現在)
※表中の推定接種者数は、ワクチン接種円滑化システム(V-SYS)のロット番号別納入数に基づくもの(7/13時点)。
※8月25日合同部会資料までは、出荷されたロットのうち、副反応疑い報告がなされたロットを計上。9月10日合同部会資料以降は、出荷されたロットについて集計。
※ロット名「0」については、5/24に配送予定であったが、その後キャンセルとなったもの。なお、ロット名「NP001」として5/27に配送されている。
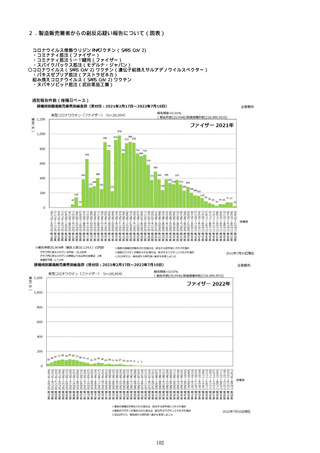
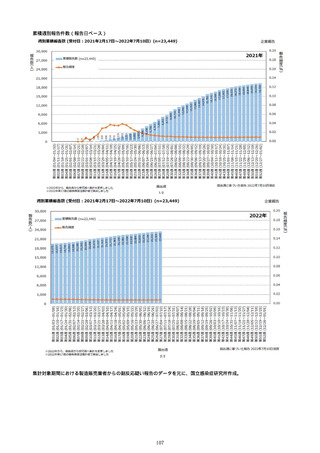
※予防接種後副反応疑い報告書の別紙様式1の報告基準に記載のある症状(「その他の反応」は除く。)について、報告状況をもとに集計を行った。アナフィラキシーは、接種開始日(コミナティ筋注:令和
3年2月17日、コミナティ筋注5〜11歳用:令和4年2月21日、スパイクバックス筋注:令和3年5月22日、バキスゼブリア筋注:令和3年8月3日、ヌバキソビッド筋注:令和4年5月25日)以降の累計報告
件数。TTSは、いずれのワクチンも令和3年8月3日以降に第一報の報告がなされたものの累計件数。心筋炎及び心膜炎は、いずれのワクチンも令和3年12月6日以降に第一報の報告がなされたものの累計件
数。
※アナフィラキシー、心筋炎又は心膜炎事例として医療機関から報告されたものを集計したものであり、ブライトン分類による評価を経て集計したものではない。ブライトン分類でレベル4又は5と分類され
たものを含む。
なお、集計対象のMedDRA PT(ver.25.0)は以下のとおり。
【アナフィラキシー】:アナフィラキシーショック、アナフィラキシー様ショック、アナフィラキシー反応、アナフィラキシー様反応
【心筋炎】:免疫性心筋炎、好酸球性心筋炎、巨細胞性心筋炎、心筋炎、自己免疫性心筋炎、心筋心膜炎
【心膜炎】:心膜炎、胸膜心膜炎、自己免疫性心膜炎
※TTS:血栓症(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)
※TTS疑い事例として医療機関から報告されたものを集計したものであり、ブライトン分類による評価を経て集計したものではない。ブライトン分類でレベル4又は5と分類されたものを含む。
MedDRA (ver.25.0)にて、TTS関連事象を集計。
101