よむ、つかう、まなぶ。
参考資料1-8 浜口班の議論における参考資料(令和3年12月6日開催)(令和3年度第6回安全技術調査会参考資料1-3) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
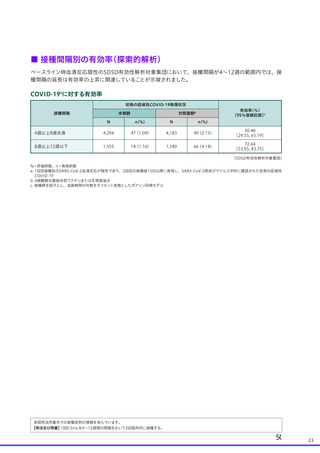
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
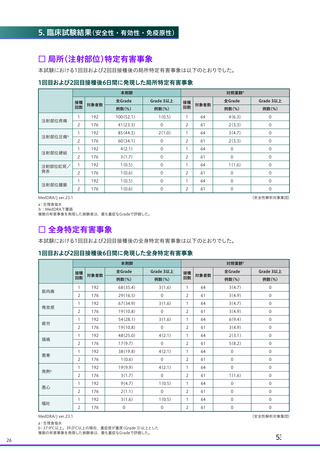
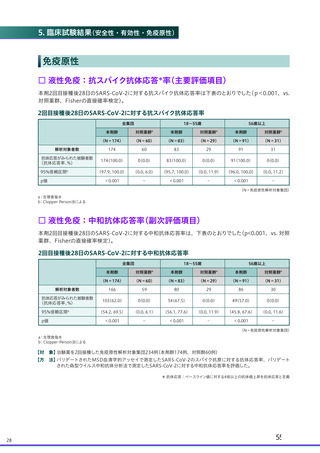
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
VAX1.
0
注意−特例承認医薬品
2021年5月作成(第1版)
日本標準商品分類番号
876313
ウイルスワクチン類
生物学的製剤基準
コロナウイルス
(SARSCoV2)
ワクチン
(遺伝子組換えサルアデノウイルスベクター)
貯
法:2〜8℃で保存
有効期間:6カ月
生物由来製品、劇薬、
処方箋医薬品注)
承認番号
販売開始
注意−医師等の処方箋により使用すること
30300AMX00267
2021年5月
本剤は、本邦で特例承認されたものであり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き情報を収集
中である。
本剤の使用にあたっては、あらかじめ被接種者又は代諾者に、本剤に関する最新の有効性及び安全性について文書で説明した上で、予診票等
で文書による同意を得た上で接種すること。また、有害事象が認められた際には、必要に応じて予防接種法に基づく副反応疑い報告制度等に
基づき報告すること。なお、
本剤の製造販売後に収集された情報については、
最新の情報を随時参照すること。
2.接種不適当者
(予防接種を受けることが適当でない者)
2.
1 明らかな発熱を呈している者
8.重要な基本的注意
8.
1 本剤は「予防接種実施規則」及び「新型コロナウイルス感染症に
係る臨時の予防接種実施要領」
に準拠して使用すること。
2.
2 重篤な急性疾患にかかっていることが明らかな者
2.
3 本剤の成分に対し重度の過敏症の既往歴のある者[8.
5、
9.
1.
6、11.
1.
1参照]
8.
2 被接種者について、接種前に必ず問診、検温及び診察によって健
康状態を調べること。
[9.
1参照]
8.
3 ワクチン接種直後又は接種後に注射による心因性反応を含む血
2.
4 SARSCoV2ワクチンの接種後に血小板減少症を伴う静脈
管迷走神経反射として失神があらわれることがある。失神による
もしくは動脈の血栓症を発現したことがある者[8.
8、11.
1.
2、
転倒を避けるため、接種後一定時間は座らせるなどした上で被接
15.
1参照]
種者の状態を観察することが望ましい。
2.
5 上記に掲げる者のほか、予防接種を行うことが不適当な状態
8.
4 被接種者又はその保護者に、接種当日は過激な運動は避け、接種
にある者
部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常
反応や体調の変化、さらに高熱、痙攣等の症状を呈した場合には、
3.製法の概要及び組成・性状
速やかに医師の診察を受けるよう指導すること。
3.
1 製法の概要
本剤は、SARSCoV2のスパイクタンパク質のアミノ酸配列を
8.
5 本剤接種後にショック、アナフィラキシーがあらわれることが
あるので、接種前に過敏症の既往歴等に関する問診を十分に行い、
コードする遺伝子を組み込んだサルアデノウイルスをヒト胎児腎
由来細胞で増殖させ、精製後、安定剤を添加して調製した注射液で
接種後一定時間、被接種者の状態を観察することが望ましい。本剤
ある。
の初回接種時にショック、アナフィラキシーが認められた被接種
者に対しては、本剤2回目の接種を行わないこと。
[ 2.
3、9.
1.
6、
3.
2 組成
11.
1.
1参照]
1バイアル(5mL)
中
有効成分
コロナウイルス(SARSCoV2)ワクチン(遺伝子組換
8.
6 本剤との関連性は確立されていないが、本剤接種後に、非常にま
れに脱髄疾患が報告されている。被接種者に対しては、脱髄疾患が
えサルアデノウイルスベクター)5×1011 ウイルス粒
疑われる症状(運動障害、感覚障害、筋力低下、膀胱直腸障害、視力
子量
障害等)が認められた場合には直ちに医師等に相談するよう、あら
1バイアル(5mL)
中
Lヒスチジン6mg、Lヒスチジン塩酸塩水和物2mg、
添加剤
塩化ナトリウム10mg、塩化マグネシウム1mg、エデト
酸ナトリウム水和物0.
2mg、精製白糖375mg、無水エ
タノール20mg、
ポリソルベート80 5mg
かじめ説明すること。
CoV2ワクチンの互換性に関する安全性、免
8.
7 本剤と他のSARS疫原性、
有効性のデータはない。
8.
8 本剤接種後に重篤な、血小板減少症を伴う血栓症(一部には出血
が伴う)が認められている。この中には、脳静脈洞血栓症や内臓静
3.
3 製剤の性状
脈血栓症等の、非常にまれな静脈血栓症や動脈血栓症が含まれて
性状
無色〜褐色の澄明〜乳白光を呈する液
いる。多くは本剤接種後14日以内に発現しており、致死的転帰の
pH
約6.
6
症例も報告されている。血栓塞栓症もしくは血小板減少症のリス
浸透圧比
約1.
5
ク 因 子 を 有 す る 者 へ の 接 種 に あ た っ て は 、予 防 接 種 上 の ベ ネ
フィットと潜在的なリスクを考慮すること。また、被接種者に対し
4.効能又は効果
ては、特に本剤接種の4〜28日後は重度もしくは持続的な頭痛、霧
SARSCoV2による感染症の予防
視、錯乱、痙攣発作、息切れ、胸痛、下肢腫脹、下肢痛、持続的な腹痛、
あるいは接種部位以外の皮膚の内出血もしくは点状出血等の症状
5.効能又は効果に関連する注意
に注意し、これらの症状が認められた場合には直ちに医師の診察
5.
1 本剤の予防効果の持続期間は確立していない。
を受けるように指導すること。
[2.
4、
11.
1.
2、
15.
1参照]
6.用法及び用量
9.特定の背景を有する者に関する注意
1回0.
5mLを4〜12週間の間隔をおいて2回筋肉内に接種する。
9.
1 接種要注意者
(接種の判断を行うに際し、
注意を要する者)
7.用法及び用量に関連する注意
被接種者が次のいずれかに該当すると認められる場合は、健康状
態及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防
接種の必要性、副反応、有用性について十分な説明を行い、同意を
確実に得た上で、
注意して接種すること。
[8.
2参照]
7.
1 本剤は2回接種により効果が確認されていることから、同一の効
能・効果をもつ他のワクチンと混同することなく2回接種するよ
う注意すること。
7.
2 本剤について最大の効果を得るためには8週以上の間隔をおい
て接種することが望ましい。
[17.
1.
2参照]
9.
1.
1 血小板減少症、凝固障害のある者、抗凝固療法を施行している
者
筋肉注射部位の出血や内出血のおそれがある。
7.
3 本剤の接種は18歳以上の者に行う。
−1−
24
0
注意−特例承認医薬品
2021年5月作成(第1版)
日本標準商品分類番号
876313
ウイルスワクチン類
生物学的製剤基準
コロナウイルス
(SARSCoV2)
ワクチン
(遺伝子組換えサルアデノウイルスベクター)
貯
法:2〜8℃で保存
有効期間:6カ月
生物由来製品、劇薬、
処方箋医薬品注)
承認番号
販売開始
注意−医師等の処方箋により使用すること
30300AMX00267
2021年5月
本剤は、本邦で特例承認されたものであり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き情報を収集
中である。
本剤の使用にあたっては、あらかじめ被接種者又は代諾者に、本剤に関する最新の有効性及び安全性について文書で説明した上で、予診票等
で文書による同意を得た上で接種すること。また、有害事象が認められた際には、必要に応じて予防接種法に基づく副反応疑い報告制度等に
基づき報告すること。なお、
本剤の製造販売後に収集された情報については、
最新の情報を随時参照すること。
2.接種不適当者
(予防接種を受けることが適当でない者)
2.
1 明らかな発熱を呈している者
8.重要な基本的注意
8.
1 本剤は「予防接種実施規則」及び「新型コロナウイルス感染症に
係る臨時の予防接種実施要領」
に準拠して使用すること。
2.
2 重篤な急性疾患にかかっていることが明らかな者
2.
3 本剤の成分に対し重度の過敏症の既往歴のある者[8.
5、
9.
1.
6、11.
1.
1参照]
8.
2 被接種者について、接種前に必ず問診、検温及び診察によって健
康状態を調べること。
[9.
1参照]
8.
3 ワクチン接種直後又は接種後に注射による心因性反応を含む血
2.
4 SARSCoV2ワクチンの接種後に血小板減少症を伴う静脈
管迷走神経反射として失神があらわれることがある。失神による
もしくは動脈の血栓症を発現したことがある者[8.
8、11.
1.
2、
転倒を避けるため、接種後一定時間は座らせるなどした上で被接
15.
1参照]
種者の状態を観察することが望ましい。
2.
5 上記に掲げる者のほか、予防接種を行うことが不適当な状態
8.
4 被接種者又はその保護者に、接種当日は過激な運動は避け、接種
にある者
部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常
反応や体調の変化、さらに高熱、痙攣等の症状を呈した場合には、
3.製法の概要及び組成・性状
速やかに医師の診察を受けるよう指導すること。
3.
1 製法の概要
本剤は、SARSCoV2のスパイクタンパク質のアミノ酸配列を
8.
5 本剤接種後にショック、アナフィラキシーがあらわれることが
あるので、接種前に過敏症の既往歴等に関する問診を十分に行い、
コードする遺伝子を組み込んだサルアデノウイルスをヒト胎児腎
由来細胞で増殖させ、精製後、安定剤を添加して調製した注射液で
接種後一定時間、被接種者の状態を観察することが望ましい。本剤
ある。
の初回接種時にショック、アナフィラキシーが認められた被接種
者に対しては、本剤2回目の接種を行わないこと。
[ 2.
3、9.
1.
6、
3.
2 組成
11.
1.
1参照]
1バイアル(5mL)
中
有効成分
コロナウイルス(SARSCoV2)ワクチン(遺伝子組換
8.
6 本剤との関連性は確立されていないが、本剤接種後に、非常にま
れに脱髄疾患が報告されている。被接種者に対しては、脱髄疾患が
えサルアデノウイルスベクター)5×1011 ウイルス粒
疑われる症状(運動障害、感覚障害、筋力低下、膀胱直腸障害、視力
子量
障害等)が認められた場合には直ちに医師等に相談するよう、あら
1バイアル(5mL)
中
Lヒスチジン6mg、Lヒスチジン塩酸塩水和物2mg、
添加剤
塩化ナトリウム10mg、塩化マグネシウム1mg、エデト
酸ナトリウム水和物0.
2mg、精製白糖375mg、無水エ
タノール20mg、
ポリソルベート80 5mg
かじめ説明すること。
CoV2ワクチンの互換性に関する安全性、免
8.
7 本剤と他のSARS疫原性、
有効性のデータはない。
8.
8 本剤接種後に重篤な、血小板減少症を伴う血栓症(一部には出血
が伴う)が認められている。この中には、脳静脈洞血栓症や内臓静
3.
3 製剤の性状
脈血栓症等の、非常にまれな静脈血栓症や動脈血栓症が含まれて
性状
無色〜褐色の澄明〜乳白光を呈する液
いる。多くは本剤接種後14日以内に発現しており、致死的転帰の
pH
約6.
6
症例も報告されている。血栓塞栓症もしくは血小板減少症のリス
浸透圧比
約1.
5
ク 因 子 を 有 す る 者 へ の 接 種 に あ た っ て は 、予 防 接 種 上 の ベ ネ
フィットと潜在的なリスクを考慮すること。また、被接種者に対し
4.効能又は効果
ては、特に本剤接種の4〜28日後は重度もしくは持続的な頭痛、霧
SARSCoV2による感染症の予防
視、錯乱、痙攣発作、息切れ、胸痛、下肢腫脹、下肢痛、持続的な腹痛、
あるいは接種部位以外の皮膚の内出血もしくは点状出血等の症状
5.効能又は効果に関連する注意
に注意し、これらの症状が認められた場合には直ちに医師の診察
5.
1 本剤の予防効果の持続期間は確立していない。
を受けるように指導すること。
[2.
4、
11.
1.
2、
15.
1参照]
6.用法及び用量
9.特定の背景を有する者に関する注意
1回0.
5mLを4〜12週間の間隔をおいて2回筋肉内に接種する。
9.
1 接種要注意者
(接種の判断を行うに際し、
注意を要する者)
7.用法及び用量に関連する注意
被接種者が次のいずれかに該当すると認められる場合は、健康状
態及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防
接種の必要性、副反応、有用性について十分な説明を行い、同意を
確実に得た上で、
注意して接種すること。
[8.
2参照]
7.
1 本剤は2回接種により効果が確認されていることから、同一の効
能・効果をもつ他のワクチンと混同することなく2回接種するよ
う注意すること。
7.
2 本剤について最大の効果を得るためには8週以上の間隔をおい
て接種することが望ましい。
[17.
1.
2参照]
9.
1.
1 血小板減少症、凝固障害のある者、抗凝固療法を施行している
者
筋肉注射部位の出血や内出血のおそれがある。
7.
3 本剤の接種は18歳以上の者に行う。
−1−
24