よむ、つかう、まなぶ。
参考資料1-8 浜口班の議論における参考資料(令和3年12月6日開催)(令和3年度第6回安全技術調査会参考資料1-3) (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
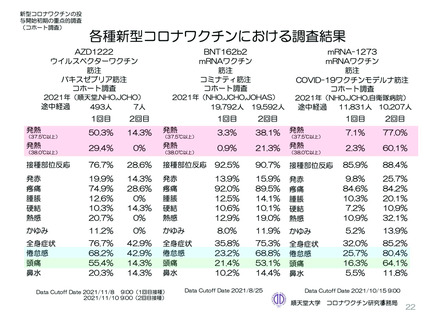
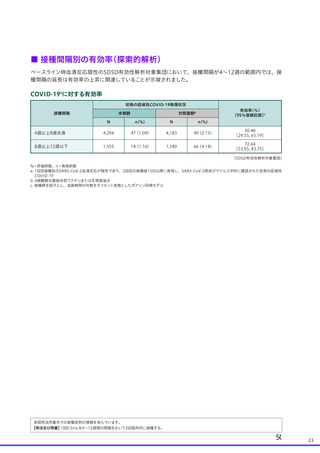
5. 臨床試験結果(安全性・有効性・免疫原性)
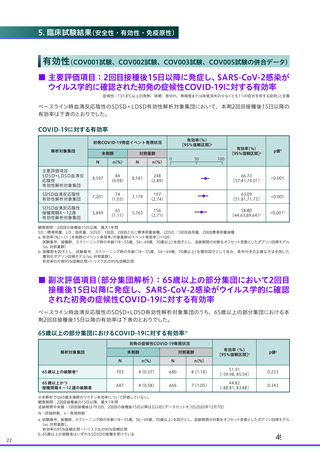
□ 局所(注射部位)特定有害事象
1回目および2回目接種後7日間に発現したワクチン接種と一般的に関連する主な局所(注射部位)特定有害事
象は、下表のとおりでした。
1回目および2回目接種後7日間に発現した局所(注射部位)特定有害事象
全体
注射部位圧痛
注射部位疼痛
注射部位熱感
注射部位挫傷
注射部位そう痒
注射部位腫脹
注射部位硬結
注射部位発赤
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,656
1,922
2,655
1,920
1,745
1,011
1,745
1,011
910
909
2,655
1,920
2,622
1,876
1,745
1,011
2,623
1,877
本剤群
全Grade
例数(%)
1,845(69.5)
886(46.1)
1,587(59.8)
732(38.1)
893(51.2)
273(27.0)
274(15.7)
78(7.7)
124(13.6)
85(9.4)
278(10.5)
161(8.4)
73(2.8)
27(1.4)
45(2.6)
7(0.7)
63(2.4)
23(1.2)
Grade 3以上
例数(%)
38(1.4)
18(0.9)
25(0.9)
14(0.7)
9(0.5)
0
0
0
4(0.4)
4(0.4)
8(0.3)
7(0.4)
2(0.1)
0
2(0.1)
0
2(0.1)
0
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,496
1,796
2,496
1,794
1,593
895
1,593
895
902
899
2,495
1,794
2,466
1,745
1,593
895
2,466
1,744
局所の有害事象名は国内臨床成績安全性の項に併せた記載とした
a:4価髄膜炎菌結合型ワクチンまたは生理食塩水
対照薬群a
全Grade
例数(%)
1,094(43.8)
498(27.7)
892(35.7)
411(22.9)
521(32.7)
190(21.2)
207(13.0)
75(8.4)
41(4.5)
33(3.7)
150(6.0)
78(4.3)
34(1.4)
10(0.6)
28(1.8)
12(1.3)
30(1.2)
6(0.3)
Grade 3以上
例数(%)
14(0.6)
7(0.4)
4(0.2)
4(0.2)
2(0.1)
1(0.1)
0
0
4(0.4)
1(0.1)
5(0.2)
1(0.1)
0
0
0
0
2(0.1)
1(0.1)
(1回目SD安全性解析対象集団)
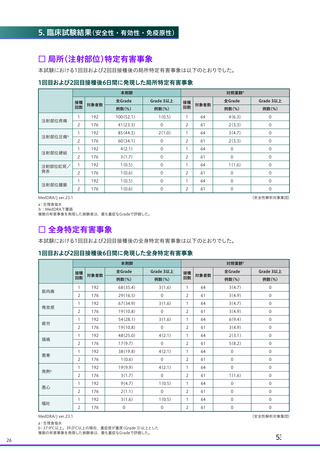
□ 全身特定有害事象
1回目および2回目接種後7日間に発現したワクチン接種と一般的に関連する全身特定有害事象は下表のとお
りでした。
1回目および2回目接種後7日間に発現した全身特定有害事象
全体
疲労
頭痛
倦怠感
筋肉痛
発熱感b
悪寒
関節痛
悪心
発熱c
嘔吐
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,664
1,925
2,655
1,922
2,655
1,922
1,745
1,011
2,655
1,921
1,745
1,011
1,745
1,011
2,655
1,921
1,745
1,011
2,588
1,873
1,745
1,011
本剤群
全Grade
例数(%)
1,851(69.5)
855(44.4)
1,317(49.6)
515(26.8)
1,291(48.6)
514(26.7)
711(40.7)
172(17.0)
1,071(40.3)
364(18.9)
546(31.3)
94(9.3)
544(31.2)
54
(5.3)
634(23.9)
195(10.2)
353(20.2)
83(8.2)
184(7.1)
23
(1.2)
24(1.4)
7
(0.7)
Grade 3以上
例数(%)
197(7.4)
40(2.1)
71(2.7)
20(1.0)
63(2.4)
16(0.8)
62(3.6)
7(0.7)
43(1.6)
10(0.5)
61(3.5)
2(0.2)
61(3.5)
2(0.2)
28(1.1)
7(0.4)
12(0.7)
3(0.3)
17(0.7)
2(0.1)
4(0.2)
2(0.2)
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,502
1,799
2,496
1,796
2,496
1,796
1,593
895
2,495
1,794
1,593
895
1,593
895
2,494
1,794
1,593
895
2,422
1,765
1,593
895
a:4価髄膜炎菌結合型ワクチンまたは生理食塩水
b:主観的な発熱の感覚
c:38.0°C 以上。39.0°C
(COV005 試験のみ39.3°C)以上の場合、重症度が重度(Grade 3)以上とした
18
対照薬群a
全Grade
例数(%)
1,342(53.6)
648(36.0)
834(33.4)
360(20.0)
844(33.8)
381(21.2)
267(16.8)
100(11.2)
463(18.6)
193(10.8)
141(8.9)
46(5.1)
107(6.7)
37(4.1)
242(9.7)
134(7.5)
176(11.0)
64(7.2)
22(0.9)
19(1.1)
13(0.8)
3(0.3)
Grade 3以上
例数(%)
41(1.6)
32(1.8)
18(0.7)
11(0.6)
15(0.6)
16(0.9)
4(0.3)
3(0.3)
6(0.2)
5(0.3)
1(0.1)
1(0.1)
0
0
7(0.3)
7(0.4)
1(0.1)
1(0.1)
4(0.2)
3(0.2)
1(0.1)
1(0.1)
(1回目SD安全性解析対象集団)
45
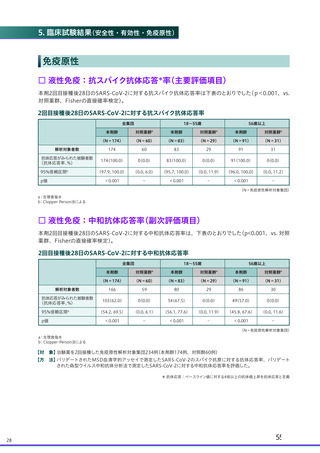
□ 局所(注射部位)特定有害事象
1回目および2回目接種後7日間に発現したワクチン接種と一般的に関連する主な局所(注射部位)特定有害事
象は、下表のとおりでした。
1回目および2回目接種後7日間に発現した局所(注射部位)特定有害事象
全体
注射部位圧痛
注射部位疼痛
注射部位熱感
注射部位挫傷
注射部位そう痒
注射部位腫脹
注射部位硬結
注射部位発赤
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,656
1,922
2,655
1,920
1,745
1,011
1,745
1,011
910
909
2,655
1,920
2,622
1,876
1,745
1,011
2,623
1,877
本剤群
全Grade
例数(%)
1,845(69.5)
886(46.1)
1,587(59.8)
732(38.1)
893(51.2)
273(27.0)
274(15.7)
78(7.7)
124(13.6)
85(9.4)
278(10.5)
161(8.4)
73(2.8)
27(1.4)
45(2.6)
7(0.7)
63(2.4)
23(1.2)
Grade 3以上
例数(%)
38(1.4)
18(0.9)
25(0.9)
14(0.7)
9(0.5)
0
0
0
4(0.4)
4(0.4)
8(0.3)
7(0.4)
2(0.1)
0
2(0.1)
0
2(0.1)
0
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,496
1,796
2,496
1,794
1,593
895
1,593
895
902
899
2,495
1,794
2,466
1,745
1,593
895
2,466
1,744
局所の有害事象名は国内臨床成績安全性の項に併せた記載とした
a:4価髄膜炎菌結合型ワクチンまたは生理食塩水
対照薬群a
全Grade
例数(%)
1,094(43.8)
498(27.7)
892(35.7)
411(22.9)
521(32.7)
190(21.2)
207(13.0)
75(8.4)
41(4.5)
33(3.7)
150(6.0)
78(4.3)
34(1.4)
10(0.6)
28(1.8)
12(1.3)
30(1.2)
6(0.3)
Grade 3以上
例数(%)
14(0.6)
7(0.4)
4(0.2)
4(0.2)
2(0.1)
1(0.1)
0
0
4(0.4)
1(0.1)
5(0.2)
1(0.1)
0
0
0
0
2(0.1)
1(0.1)
(1回目SD安全性解析対象集団)
□ 全身特定有害事象
1回目および2回目接種後7日間に発現したワクチン接種と一般的に関連する全身特定有害事象は下表のとお
りでした。
1回目および2回目接種後7日間に発現した全身特定有害事象
全体
疲労
頭痛
倦怠感
筋肉痛
発熱感b
悪寒
関節痛
悪心
発熱c
嘔吐
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,664
1,925
2,655
1,922
2,655
1,922
1,745
1,011
2,655
1,921
1,745
1,011
1,745
1,011
2,655
1,921
1,745
1,011
2,588
1,873
1,745
1,011
本剤群
全Grade
例数(%)
1,851(69.5)
855(44.4)
1,317(49.6)
515(26.8)
1,291(48.6)
514(26.7)
711(40.7)
172(17.0)
1,071(40.3)
364(18.9)
546(31.3)
94(9.3)
544(31.2)
54
(5.3)
634(23.9)
195(10.2)
353(20.2)
83(8.2)
184(7.1)
23
(1.2)
24(1.4)
7
(0.7)
Grade 3以上
例数(%)
197(7.4)
40(2.1)
71(2.7)
20(1.0)
63(2.4)
16(0.8)
62(3.6)
7(0.7)
43(1.6)
10(0.5)
61(3.5)
2(0.2)
61(3.5)
2(0.2)
28(1.1)
7(0.4)
12(0.7)
3(0.3)
17(0.7)
2(0.1)
4(0.2)
2(0.2)
接種
回数
対象者数
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
1
2
2,502
1,799
2,496
1,796
2,496
1,796
1,593
895
2,495
1,794
1,593
895
1,593
895
2,494
1,794
1,593
895
2,422
1,765
1,593
895
a:4価髄膜炎菌結合型ワクチンまたは生理食塩水
b:主観的な発熱の感覚
c:38.0°C 以上。39.0°C
(COV005 試験のみ39.3°C)以上の場合、重症度が重度(Grade 3)以上とした
18
対照薬群a
全Grade
例数(%)
1,342(53.6)
648(36.0)
834(33.4)
360(20.0)
844(33.8)
381(21.2)
267(16.8)
100(11.2)
463(18.6)
193(10.8)
141(8.9)
46(5.1)
107(6.7)
37(4.1)
242(9.7)
134(7.5)
176(11.0)
64(7.2)
22(0.9)
19(1.1)
13(0.8)
3(0.3)
Grade 3以上
例数(%)
41(1.6)
32(1.8)
18(0.7)
11(0.6)
15(0.6)
16(0.9)
4(0.3)
3(0.3)
6(0.2)
5(0.3)
1(0.1)
1(0.1)
0
0
7(0.3)
7(0.4)
1(0.1)
1(0.1)
4(0.2)
3(0.2)
1(0.1)
1(0.1)
(1回目SD安全性解析対象集団)
45