よむ、つかう、まなぶ。
再生医療等安全性確保法施行5年後の見直しに係る検討 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23718.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第72回 2/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
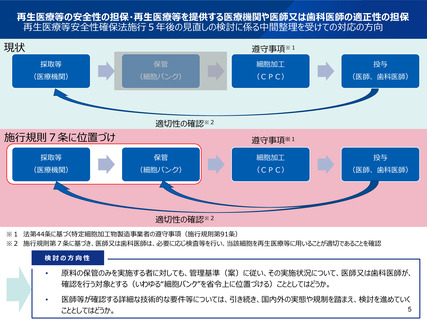
2(4)細胞培養加工施設(CPC)の質の担保
<届出制としているCPCへの実地調査について>
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
•
医療機関内に設置されるCPC等における特定細胞加工物の製造については、法第40 条において、届出制としている。この場合、
構造設備の確認を書面で行うのみで、実地調査は行わないこととなっており、当該届出が受理された後は、更新も必要ないことから、設
備の状況の実地確認は行われない。
(特定細胞加工物の製造の届出)
第四十条 細胞培養加工施設(病院若しくは診療所に設置されるもの、医薬品医療機器等法第二十三条の二十二第一項の許可(厚生労働省令で定める
区分に該当するものに限る。)を受けた製造所に該当するもの又は移植に用いる造血幹細胞の適切な提供の推進に関する法律第三十条第一項の臍帯血
供給事業の許可を受けた者が臍帯血供給事業の用に供するものに限る。以下この条において同じ。)において特定細胞加工物の製造をしようとする者
は、厚生労働省令で定めるところにより、細胞培養加工施設ごとに、次に掲げる事項を厚生労働大臣に届け出なければならない。
一 氏名又は名称及び住所並びに法人にあっては、その代表者の氏名
二 細胞培養加工施設の管理者の氏名及び略歴
三 製造をしようとする特定細胞加工物の種類
四 その他厚生労働省令で定める事項
(略)
議論
•
医療機関内に設置するCPCについても、届出だけではなく、実地調査に入るべきではないかとの意見があった一方、全ての届出制の
CPC(令和元年10 月現在で2,687 施設)に対し実地調査を行うのは現実的ではないため、まずは一部のCPCに対し調査を
行ってはどうかとの意見があった。
今後の対応の方向性
•
届出制のCPCの構造基準の遵守状況について、まずは、リスクに応じて一部のCPCの調査を行うことにより、実態の把握等を行う
ことを検討すべきである。
11
<届出制としているCPCへの実地調査について>
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
•
医療機関内に設置されるCPC等における特定細胞加工物の製造については、法第40 条において、届出制としている。この場合、
構造設備の確認を書面で行うのみで、実地調査は行わないこととなっており、当該届出が受理された後は、更新も必要ないことから、設
備の状況の実地確認は行われない。
(特定細胞加工物の製造の届出)
第四十条 細胞培養加工施設(病院若しくは診療所に設置されるもの、医薬品医療機器等法第二十三条の二十二第一項の許可(厚生労働省令で定める
区分に該当するものに限る。)を受けた製造所に該当するもの又は移植に用いる造血幹細胞の適切な提供の推進に関する法律第三十条第一項の臍帯血
供給事業の許可を受けた者が臍帯血供給事業の用に供するものに限る。以下この条において同じ。)において特定細胞加工物の製造をしようとする者
は、厚生労働省令で定めるところにより、細胞培養加工施設ごとに、次に掲げる事項を厚生労働大臣に届け出なければならない。
一 氏名又は名称及び住所並びに法人にあっては、その代表者の氏名
二 細胞培養加工施設の管理者の氏名及び略歴
三 製造をしようとする特定細胞加工物の種類
四 その他厚生労働省令で定める事項
(略)
議論
•
医療機関内に設置するCPCについても、届出だけではなく、実地調査に入るべきではないかとの意見があった一方、全ての届出制の
CPC(令和元年10 月現在で2,687 施設)に対し実地調査を行うのは現実的ではないため、まずは一部のCPCに対し調査を
行ってはどうかとの意見があった。
今後の対応の方向性
•
届出制のCPCの構造基準の遵守状況について、まずは、リスクに応じて一部のCPCの調査を行うことにより、実態の把握等を行う
ことを検討すべきである。
11