よむ、つかう、まなぶ。
資料2-2 チェストベリー乾燥エキスのリスク区分について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
調査結果に関する見解と今後の安全対策
本調査期間(2014 年 9 月 10 日~2022 年 4 月 2 日)の製造販売後調査結果に関する見
解と今後の安全対策は以下のとおりである。
1.
製造販売後調査の副作用状況に関する見解
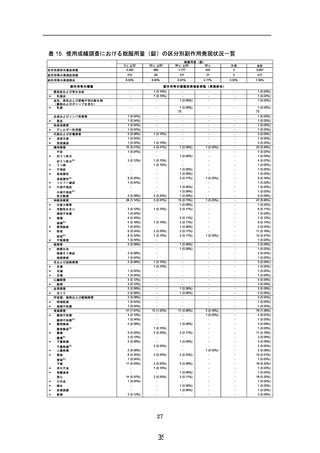
当該調査期間中に収集した症例 5,709 例中、安全性解析対象症例の 5,667 例のうち、
副作用は 417 例認められ、副作用の発現割合は 7.36%であった。
「重篤」な副作用とし
ては、使用上の注意から予測できない「乳癌」1 例(0.02%)のみが認められたが、本剤
との関連性は不明であった。
一般調査にて使用上の注意から予測できない副作用の報告は、87 例 101 件であった。
これらの副作用のうち、使用上の注意から予測できない副作用について、使用上の注
意への追記等の必要性を検討した。
① 使用成績調査
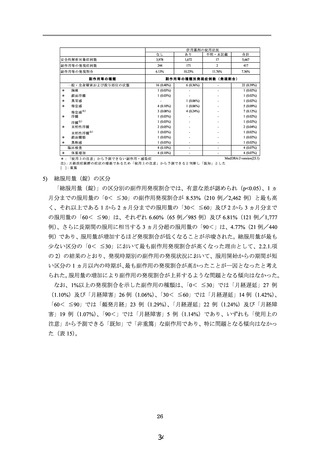
使用成績調査にて使用上の注意から予測できない副作用のうち、主な副作用の種類は
「不正子宮出血※1」19 例、
「便秘」12 例、
「腹痛」及び「傾眠」11 例であった。いずれ
も転帰は「不明」なものを除き、「軽快」または「回復」であった。
※1:MedDRA のバージョン変更に伴い、特別調査においては「不正子宮出血」とし
て報告を集積している事象について、一般調査では「月経中間期出血」とされている。
② 一般調査
一般調査にて使用上の注意から予測できない副作用の報告は、87 例 101 件であった。
主な副作用の種類は、「月経中間期出血」14 例、
「頭痛」12 例、「腹痛」7 例であった。
いずれも転帰は「不明」なものを除き、「軽快」または「回復」であった。
総合機構に報告した重篤の副作用は、
「乳癌」の 1 例であり、本剤の「使用上の注意」
に記載のない「未知」の副作用であった。本剤服用後に早期乳癌と診断されているもの
の、本剤との関連性が明確ではなく、また、現在までの集積が本症例の 1 例のみである
ことから、「使用上の注意」を改訂するには根拠が不十分なため、措置不要と判断し、
今後も同様の症例の集積に努めることとした。
その他の「未知」の副作用については、本剤継続中に回復している症例や、本剤以外
の要因が疑われる症例等、関連性が不明確な症例が多く、本剤との関連性が高いと判断
できる症例の集積に乏しいことから、現時点では「使用上の注意」の改訂等の安全確保
措置を要する事項はないと判断した。
なお、今後も引き続き適正な使用のために必要な情報の収集並びに検討を随時行い、
必要に応じて安全確保措置を講じていく。
2
本調査期間(2014 年 9 月 10 日~2022 年 4 月 2 日)の製造販売後調査結果に関する見
解と今後の安全対策は以下のとおりである。
1.
製造販売後調査の副作用状況に関する見解
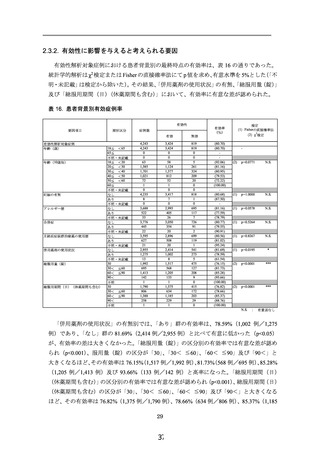
当該調査期間中に収集した症例 5,709 例中、安全性解析対象症例の 5,667 例のうち、
副作用は 417 例認められ、副作用の発現割合は 7.36%であった。
「重篤」な副作用とし
ては、使用上の注意から予測できない「乳癌」1 例(0.02%)のみが認められたが、本剤
との関連性は不明であった。
一般調査にて使用上の注意から予測できない副作用の報告は、87 例 101 件であった。
これらの副作用のうち、使用上の注意から予測できない副作用について、使用上の注
意への追記等の必要性を検討した。
① 使用成績調査
使用成績調査にて使用上の注意から予測できない副作用のうち、主な副作用の種類は
「不正子宮出血※1」19 例、
「便秘」12 例、
「腹痛」及び「傾眠」11 例であった。いずれ
も転帰は「不明」なものを除き、「軽快」または「回復」であった。
※1:MedDRA のバージョン変更に伴い、特別調査においては「不正子宮出血」とし
て報告を集積している事象について、一般調査では「月経中間期出血」とされている。
② 一般調査
一般調査にて使用上の注意から予測できない副作用の報告は、87 例 101 件であった。
主な副作用の種類は、「月経中間期出血」14 例、
「頭痛」12 例、「腹痛」7 例であった。
いずれも転帰は「不明」なものを除き、「軽快」または「回復」であった。
総合機構に報告した重篤の副作用は、
「乳癌」の 1 例であり、本剤の「使用上の注意」
に記載のない「未知」の副作用であった。本剤服用後に早期乳癌と診断されているもの
の、本剤との関連性が明確ではなく、また、現在までの集積が本症例の 1 例のみである
ことから、「使用上の注意」を改訂するには根拠が不十分なため、措置不要と判断し、
今後も同様の症例の集積に努めることとした。
その他の「未知」の副作用については、本剤継続中に回復している症例や、本剤以外
の要因が疑われる症例等、関連性が不明確な症例が多く、本剤との関連性が高いと判断
できる症例の集積に乏しいことから、現時点では「使用上の注意」の改訂等の安全確保
措置を要する事項はないと判断した。
なお、今後も引き続き適正な使用のために必要な情報の収集並びに検討を随時行い、
必要に応じて安全確保措置を講じていく。
2